
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способность организовывать сотрудничество обучающихся, поддерживать активность и инициативность, самостоятельность обучающихся, их творческие способности» (ПК-7
|
|
|
|
Формирование знаний о составе, строении, химических процессах в атмосфере
Цели.
3. Формирование знаний по оценке современного состояния отдельных геосфер или их частей, прогноза изменения их состояния в условиях антропогенного воздействия, разработки мероприятий по снижению уровня воздействия на геосферы или их составные части.
Содержание
Фотохимические процессы в атмосфере. Реакционная способность следовых веществ в атмосфере. Состав атмосферы. Строение. Физические процессы. Солнечная радиация. Энергия различных видов излучения. Озон. Парниковый эффект. Дисперсные системы в атмосфере. Смог. Превращение органических соединений в тропосфере. Источники загрязнений
Интерактивная форма: Работа с интерактивным оборудованием по изучению трансформации основных промышленных аэрозолей.
Атмосфера многократно изменяла свой состав и свойства и приблизилась к современным параметрам в девоне. В настоящее время основной фнкцией может считаться предохранение живого мира от ионизирующей радиации. Особенностью химических процессов является участие в них свободных электронов которые на поверхности Земли не имеются.
Согласно современным представлениям, Земля образовалась около 4,6 млрд. лет назад из протопланетного газопылевого облака, рассеянного в околосолнечном пространстве содержавшего водород (Н2) и гелий (Не) с небольшими примесями других газов. Первичная атмосфера из газово-пылевого облака, была утрачена в период образования планеты. Это объясняется тем, что благородные газы - гелий (He), неон (Ne) и аргон (Ar) - гораздо больше распространены в космосе, чем в современной земной атмосфере.
Выделение тепловой энергии (процессы гравитационного сжатия, радиоактивный распад короткоживущих изотопов, таких как 26А1, и долгоживущих изотопов урана, тория, калия и рубидия) вызывало расплавление пород планеты и выделению газообразных веществ. Формирование плотной атмосферы вокруг остывающей Земли происходило за счет паров и газов, выделившихся в результате дегазации мантии. Пылевые частицы состояли изо льда, образовавшегося при конденсации воды (Н2О), аммиака (NH3) и метана (CH4), а также, возможно, других простейших органических соединений, таких как ацетонитрил (СН3 - С = N), формальдегид (НСОН). Данные соединения обнаружены в космосе.
|
|
|
Процесс образования вторичной атмосферы связывают с действием вулканов. Вулканические газы в течение первых 500 млн. лет существования планеты, состояли главным образом из водорода, водяного пара, метана и оксидов углерода (II) и (IV) (СО, СО2) с примесью некоторых соединений серы (SO2, H2S). Конденсация водяного пара 4 млрд. лет назад привела к образованию гидросферы. Очевидно, уже на этой стадии должны были произойти значительные изменения в составе атмосферы. Наиболее важными факторами ранней эволюции атмосферы наряду с продолжавшейся дегазацией мантии являлись такие процессы, как растворение углекислого газа (СО2) в водоемах (это привело впоследствии к образованию древнейших осадочных пород), улетучивание в космос водорода и гелия и, как следствие, увеличение относительного содержания азота.
В связи с повышенной распространенностью водорода в первичной атмосфере возникали простейшие его соединения с углеродом и азотом. Поскольку наиболее стабильной формой углерода был угарный газ (СО), то по мере охлаждения солнечной туманности происходили следующие реакции:
2CO + 2H2O = CH4 + CO2,
СО2 + Н2 = CH4 + 2H2O,
N2 + 3H2 =2NH3,
При падении температуры газовой туманности ниже 400 К ранее выделившиеся силикаты взаимодействовали с парами воды и протекали следующие реакции:
|
|
|
3MgSiO3 + SiO2 + H2Oг? Mg3Si4O10(OH)2,
3Mg2SiO4 + 5SiO2 + H2O(г)? 2Mg3Si4O10)(OH)2
Гидратированные силикаты оказались скрытыми носителями воды в том числе за счет явления адсорбции.
Дегазация привела к формированию важнейших оболочек планеты
Благородные газы, накапливались в атмосфере. Основной вулканический газ - вода - конденсировался в виде жидкой воды, пополняя гидросферу. Следующий по распространению вулканический компонент -углекислый газ - растворялся в воде, образуя в гидросфере сложную карбонатную систему, из которой углекислота извлекалась при образовании карбонатных горных пород - известняков и доломитов:
CO2 + H2O = H2CO3 = 2Н+ + СО32-
Са2+ + СО32- = СаСО3,
Дымы HCl и HF вулканического происхождения попадали в атмосферу и гидросферу, затем переходили в ионы фтора и хлора.
HCl + OH-? Cl- + H2O,
HF + OH-? F- + H2O.
Американский ученый У. Руби считал наиболее очевидным источником атмосферных газов выветривание горных пород на основе представлений о непрерывном образовании атмосферы
Все летучие компоненты горных пород (без учета осадочных пород), выделившиеся при выветривании, не составляют и 1% от общего количества газа, содержащегося в современной атмосфере, гидросфере и осадочных породах (в качестве летучих компонентов). Отложение же таких осадочных пород, как, например, карбонаты, и вовсе не могло происходить в отсутствие атмосферы и гидросферы. Следовательно, летучие компоненты в подобных осадочных породах необходимо рассматривать как часть древней атмосферы и гидросферы, перешедшую в вещество осадочных пород.
На основании этого он заключил, что остальные 99% вещества атмосферы выделились непосредственно из мантии.
В свете последних данных оценки Руби вызывают сомнение. Ряд самых древних пород является метаморфическим, образовавшимся из осадочных пород. Следовательно, во время осаждения этих пород 3,7 млрд. лет назад должны были уже существовать моря.
Взрывоподобное образование атмосферы вытекает на основе анализа изотопного состава аргона, т. е. отношения содержания аргона-40 и аргона-36. Установлено, что современное изотопное отношение аргона в атмосфере 295,5, а внутри Земли (в ее мантии) среднее значение близко к 5000. Различие изотопного отношения можно объяснить, если только выделение газов произошло в ходе очень бурного и короткого процесса на весьма ранних стадиях развития Земли (не более чем спустя 500 млн. лет после ее образования). Кроме того, выделение газов должно было происходить очень бурно: необходимо, чтобы высвободилось около 80% аргона, захваченного Землей из протопланетного облака.
|
|
|
В рамках схемы предложенной Руби непрерывного выделения газов разница изотопных отношений аргона в атмосфере и недрах Земли совершенно необъяснима.
Если процесс выделения аргона на ранних стадиях истории Земли был очень бурным, и в ходе его высвободилось около 80% аргона, содержащегося в современной атмосфере, то предположение о выделении и остальных составляющих современной атмосферы в таком процессе кажется вполне реальным. Взрывоподобный характер выделения газов из недр Земли на очень ранних стадиях ее истории не противоречит данным других наук, указывающим на существование гидросферы в докембрии.
Эволюция атмосферы в течение геологического времени проходила под влиянием развития жизни. Любой организм состоит из углерода, кислорода, водорода и азота, т. е. из тех основных химических элементов, из которых сложены водная и воздушная оболочки нашей планеты. Поэтому естественно, что в процессе своего роста, питания и дыхания все живые организмы Земли пропускают огромные количества газовых компонентов и воздействуют на установление новых химических равновесий, на появление новых состояний вещества в атмосфере. Химическую эволюцию атмосферы совершенно невозможно понять без учета химической деятельности.
Х. Юри и С. Миллер, исследуя факторы, способствовавшие возникновению жизни на Земле, пытались получить органические молекулы из неорганических. Ими установлено, что сложные органические молекулы можно синтезировать, если пропускать электрический разряд через смесь газов, состоящую из метана, аммиака и паров воды.
Они исходили из предположения, что ранняя атмосфера имела именно такой состав, как и исследуемая смесь. В то время считалось, что первоначально, при возникновении Земли, ее атмосфера имела химический состав, схожий с составом протосолнечной туманности. В этой ранней атмосфере содержались водород, кислород (O2), а также азот (N2) и углерод, которые, вступая в реакции между собой, образовывали устойчивые химические соединения при температуре 25 С.
|
|
|
Термодинамический расчет показывает состав начальной атмосферы, состоящей из метана, аммиака, паров воды.
Абиотический синтез в добиологический период существования Земли привел, очевидно, к образованию больших количеств органического вещества предположительно однопроцентного раствора и зарождению жизни 4 млрд. или более лет назад, так как такой возраст имеют породы, сохранившие органические микроструктуры, которые могли быть остатками примитивных микроорганизмов.
Возникновение основных компонентов атмосферы
Основные компоненты современной атмосферы земли - это азот, кислород, углекислый газ, аргон.
В составе газов, извергаемых современными вулканами нет кислорода возможно его не было и раньше. Молекулы воды в первичной атмосфере под действием энергии ультрафиолетового излучениямогт разлагаться:
H2O + hi? H2 + 1/2O2.
Водород как легкий элемент улетучивался в космическое пространство, тогда как атомы кислорода соединялись с молекулами кислорода в озон:
O2 + O-? O3.
С течением времени вследствие постоянного действия защитной озоновой оболочки мощные потоки солнечной энергии не могли достигнуть нижних слоев земной атмосферы и дальнейший синтез органических соединений стал невозможен. В результате реакции фотосинтеза
mCO2 + 11H2O + энергия? Cm(H2O)n + 11O2
свободный кислород продолжал выделяться в атмосферу. Так началось накопление кислорода.
Присутствие высокоокисленных соединений железа в красных полосах железных руд докембрия свидетельствует о наличии свободного кислорода.
В качестве основы для расчетов прошлого состава атмосферы принимается распространенность захоронения органического углерода, как прошедшего фотосинтетический этап в круговороте, связанный с высвобождением кислорода. При убывании дегазации мантии в течение геологической истории, общая масса осадочных пород постепенно приближалась к современной. При этом 4/5 углерода захоронялось в карбонатных породах, а 1 /5 приходилась на органический углерод осадочных толщ. Немецкий геохимик М. Шидловский рассчитал рост содержания свободного кислорода в течение геологической истории Земли. При этом было установлено, что примерно 39% всего кислорода, выделившегося при фотосинтезе, оказалось связанным в оксид железа (III) (Fe2O3), 56% сосредоточилось в сульфатах (SO42-) и 5% осталось в свободном состоянии в атмосфере Земли.
В раннем докембрии практически весь освобожденный кислород быстро поглощался земной корой при окислении после того, как докембрийские океаны очистились от растворенного железа, свободный кислород стал накапливаться в гидросфере и затем в атмосфере.
Новый этап в истории биосферы характеризовался тем, что в атмосфере 2000... 1800 млн. лет назад отмечалось увеличение количества свободного кислорода. Поэтому окисление железа переместилось на поверхность древних континентов в область коры выветривания, что и привело к формированию мощных древних красноцветных толщ. Поступление двухвалентного железа в океан уменьшилось, и соответственно снизилось поглощение свободного кислорода морской средой. Азот давно обнаружен в газах вулканического происхождения. При нагревании этих пород, а также метеоритов, азот освобождается в форме молекул и в виде аммиака. В первичной мантии аммиак образовался из азота и водорода в результате реакций при нагреве в восстановительных условиях. В верхних слоях атмосферы под влиянием кислорода, освобождающегося при фотодиссоциации паров воды и других соединений, аммиак окисляется до молекулярного азота:
N2 +3H2 = 2NH3,
H2O = H2 + 1/2O2,
4NH3 + 3O2? 2N2 + 6H2O.
Большая часть атмосферного углерода как в прошлом, так и в настоящем, находилась в виде углекислого газа и значительно меньшая часть - в форме метана. В вулканических газах углерод также встречается преимущественно в форме углекислого газа и меньше - в форме угарного газа и метана.
2CO + O2? 2CO2,
CO + 3H2 = CH4 + H2O,
2CO = CO2 + C(графит),
CH4 + O2? CO2 + 2H2.
Вся деятельность фотосинтезирующих организмов стала направленной на интенсивное извлечение углекислого газа из атмосферы.
Геохимическая история углерода в биосфере начинается с его поступления в виде углекислого газа и угарного газа из глубинных горизонтов мантии в результате ее дегазации, выражаемой вулканическими процессами.
Поступившая из глубинных источников углекислота распределялась в биосфере, образуя в гидросфере сложную карбонатную систему. По мере выщелачивания ионов Са2+ и Mg2+ из первичной земной коры и поступления их в океан, углекислота отлагалась в виде карбонатных пород - известняков, доломитов:
Ca2+ + H2CO3? CaCO3 + 2H+,
Mg2+ + H2CO3? MgCO3 + 2H+.
Причем более древние известняки отличались повышенным содержанием магния. Другая часть углекислоты использовалась фотосинтезом с образованием органических веществ, испытывая в дальнейшем различные превращения, включая образование в захороненном состоянии рассеянной органики, затем углей разного типа, горючих сланцев и нефти.
Большая часть аргона земной атмосферы - радиоактивного происхождения. Это, в частности, подтверждается тем, что аргон земной атмосферы на 99,6% состоит из изотопа 40Ar, в то время как для обычного космического аргона характерно преобладание 36Ar. Радиогенный аргон возникал за счет распада 40К путем электронного захвата и выделялся в атмосферу при общей дегазации планеты:
40K + e? 40Ar.
СТРОЕНИЕ И СОСТАВ АТМОСФЕРЫ
Строение атмосферы
Атмосфера характеризуется выраженной неоднородностью. Атмосфера состоит из нескольких слоев, между которыми расположены паузы. Все слои отличаются между собой температурой. В атмосфере протекают различные фотохимические реакции, которые для разных слоев в различной степени вносят вклад в нагревание атмосферы.
Нижний слой атмосферы - тропосфера - нагревается от поверхности Земли, которая в свою очередь нагревается за счет энергии Солнца. Нагрев воздуха за счет поглощения в десятки раз меньше. С высотой нагрев уменьшается, и это понижает температуру воздуха в среднем от 1 4 С на уровне моря до -55 С0 на верхней границе тропосферы. Этому способствует охлаждение и расширение поднимающегося воздуха. На верхней границе тропосферы радиационный нагрев воздуха Солнцем уравнивается с нагревом от Земли.
Выше тропосферы существует слой с постоянной низкой температурой -тропопауза. В тропиках толщина этого слоя 1 4- 1 6 км. В полярных областях тропопауза тоньше – 8- 1 0 км.
Выше тропопаузы воздух с высотой вначале медленно, а потом все быстрее нагревается примерно до -3 С на высоте около 50 км. Этот слой называется стратосферой. Стратосфера нагревается за счет поглощения ультрафиолетового излучения озоном (О3). Возможно протекание фотохимической реакции
О3 + hv? О2 + О∙
Кроме того, в стратосфере могут протекать и некоторые другие фотохимические реакции, например:
N2 + hv? N2 + + e-, О2 + hv? О2+ + e-.
На высоте 50 км расположена стратопауза.
В стратосфере с увеличением высоты температура возрастает В мезосфере воздух становится более разряженным и температура убывает с высотой. На высоте 80 км находится мезопауза. В мезосфере протекают следующие фотохимичекие реакции:
О∙ + hv? О+ + e-,
N2 + О2? N2+ + О2 +
О+ + О2? О∙ + О2+,
О+ + N2? NO+ + N
В термосфере происходит новый нагрев воздуха достигая 1500-2000 К, он также связан с поглощением ультрафиолетового излучения и сопровождается ионизацией атмосферы:
О∙ + hv? О+ + e-,
N2 + hv? 2N∙,
О+ + N2? NO+ + N∙,
NО+ + e-? N∙ + О∙,
N2+ + O∙? NO+ + N∙
Наиболее удалена от поверхности Земли экзосфера (выше 1000 км). В ней еще обнаруживаются атмосферные газы до высоты приблизительно 2000 км, хотя верхняя граница атмосферы отсутствует. В экзосфере сила притяжения Земли уже недостаточны и происходит диссипация частиц. Диссипация - это процесс преодоления атомами и ионами поля притяженияЗемли.
Вследствие разряженности столкновения атомов становятся все реже, а величина свободного пробега значительно возрастает. Так, например, на высоте 1 00 км величина свободного пробега составляет 10 см, а на высоте 220 км достигает 870 м. Кинетическая энергия таких столкновений становится настолько большой, что температура повышается на сотни градусов. Если скорость атомов и ионов при соударении превышает 11 км/с, то атомы и ионы могут легко покинуть поле притяжения Земли.
По мере удаления от Земли средняя скорость частиц увеличивается, для межзвездного газа температура равна 10 000 °С.
Поскольку при реакциях выделяются ионы, верхнюю часть атмосферы (мезосферу, термосферу и экзосферу) называют также ионосферой.
Химические реакции в атмосфере
Реакции, протекающие в атмосфере, можно классифицировать следующим образом.
Реакции фотодиссоциации. Фотодиссоциация - это распад молекул с образованием свободных радикалов в результате поглощения фотона:
О2 + hv? 2О∙.
Н2О + hv? Н∙ + ОН∙
НО∙ + hv? Н∙ + О∙
Реакции фотоионизации. Фотоионизация - это образование ионов из молекул и атомов под действием квантов света:
N2 + hv? N2+ + e-,
О2 + hv? О2+ + е-,
О∙ + hv? О+ + е-,
NO + hv? NO+ + е-.
Реакции между ионами. Реакции диссоциативной рекомбинации - это реакции иона с электронами с образованием нейтральных молекул, которые в разряженных условиях верхней атмосферы будут быстро диссоциировать:
N2 + + е-? N2? N∙ + N∙
O2+ + е-? O2 ? O∙ + O∙
NO+ + е-? NO? N∙ + O∙
Перенос заряда - это реакция молекулярного иона с нейтральной частицей, сопровождающаяся переносом электрона. Перенос заряда возможен, если энергия ионизации нейтральной молекулы меньше, чем энергия ионизации образующейся. К реакциям с переносом заряда относятся:
N2+ + O2? N2 + O2+,
O+ + O2? O∙ + O2+.
Реакции обмена - это реакции сопровождающиеся разрывом связей.
Например, следующие реакции:
N2+ + O∙? NО+ + N∙
O+ + N2? NО+ + N ∙
За счет всех выше перечисленных реакций в верхних слоях (выше 50 км) атмосфера становится электропроводной, и создаются слои отражающие радиоволны. Это позволяет проводить дальнюю радиосвязь вокруг Земли.
Состав атмосферы
Атмосфера смесь молекулярных, диссоциированных, ионизированных газов, находящихся на различных высотах, между которыми под действием солнечного излучения происходят постоянные химические реакции, это приводит к «перемешиванию» атмосферы и к постоянству ее основного состава. Различают постоянные, переменные и случайные составные части атмосферы.
Постоянные составляющие. К постоянным составляющим воздуха относятся азот, кислород, инертные газы (табл. 1). По ним состав воздуха в тропосфере, стратосфере и части ионосферы одинаков по всей высоте и над любой точкой поверхности.
Таблица 1
Количественный состав атмосферы по основным составляющим
| Компонент | Объемная доля, % | Массовая доля, % |
| Азот | 78,16 | 75,50 |
| Кислород | 20,90 | 23,20 |
| Аргон | 0,93 | 1,28 |
| Неон и другие инертные газы | 0,01 | 0,02 |
Переменные составляющие. К переменным составляющим относятся углекислый газ и водяной пар. Их содержание в воздухе меняется.
Содержание углекислого газа изменяется в пределах одной сотой процента в ту и другую сторону от средней величины, которая составляет 0,3% от объема атмосферы.
Водяной пар его концентрация составляет около 0,1 6% от объема атмосферы, колеблясь от 3% у земной поверхности до 0,00002% в Антарктиде. С высотой его количество быстро убывает. В результате конденсации водяного пара образуются облака. Облака, которые обычно закрывают около половины всей поверхности Земли, находятся в тропосфере. В верхней части атмосферы облака редки. Это так называемые перламутровые или серебристые облака.
Содержание случайных веществ зависит от источника их выделения, количества выхода в атмосферу, метеорологических условий и от плотности рассматриваемых примесей.
Случайными примесями являются различные газы, образующиеся в результате жизнедеятельности организмов, разложения органических веществ, пожаров, деятельности вулканов или иных выбросов природных газов в атмосферу, а также газы, образующиеся в результате промышленной деятельности человека. Можно привести следующие примеры случайных газов: сернистый газ, вблизи металлургических заводов; аммиак, образующийся в результате распада органических остатков; радиоактивные примеси.
На высоте 90 км химический состав атмосферы сильно изменяется. Она обогащается легкими газами. Выше 600 км в атмосфере преобладает гелий, а выше 1 600 - водород.
ОЗОНОВЫЙ СЛОЙ
Озоновый слой появился вместе с появлением в земной атмосфере кислорода. Озона в атмосфере очень мало, его объемная доля составляет всего 4 ∙10-7%. Если собрать весь озон атмосферы в один слой, то при нормальных условиях, т. е. при давлении 1 атм и температуре 273 оС, он будет иметь толщину всего лишь 0,3 см. Этого количества вполне достаточно, чтобы говорить о защитных свойствах озонового слоя, поскольку озон обладает очень сильным поглощением. Он полностью поглощает всю энергию ультрафиолетовой радиации Солнца в полосе от 290 до 220 нм.
Механизм образования озона
Синтез и разложение озона в атмосфере представляют собой сложный процесс, поскольку облучение ее Солнцем периодически изменяется по суткам и по временам года.
Расчеты по термодинамическим данным реакции
3О2 ↔ 2О3
показывают, что при низких температурах газ в основном состоит из молекулярного кислорода, а при высоких - из атомарного, и при давлении 1 атм нет никакой области температур, где равновесное парциальное давление озона было бы сколько-нибудь существенным. Поэтому правомочен вопрос: каковы же причины наблюдаемых на опыте сравнительно больших концентраций озона? В установлении равновесия большую роль играют реакция образования озона из атомарного и молекулярного кислорода и обратная ей реакция биомолекулярного разложения продукта:
О2 + О∙ + М∙ ↔ О3 + М∙
В этом уравнении Мв означает любую частицу, присутствующую в системе и необходимую для отвода энергии от образующейся молекулы озона.
При высоких температурах, когда содержание атомарного кислорода велико, равновесие реакции сильно сдвинуто влево и озон не образуется. При низких же температурах, когда равновесие по реакции сдвинуто вправо, парциальное давление атомарного кислорода слишком низкое, что также препятствует образованию озона. Для получения значительных концентраций озона необходимо сочетание двух условий: сравнительно низкой температуры, обеспечивающей достаточный сдвиг равновесия в сторону образования озона, и больших концентраций атомарного кислорода. Выполнение этих условий возможно, когда диссоциация молекул кислорода обеспечивается в результате нетермического воздействия на систему, например за счет облучения или потока быстрых частиц.
Для получения представлений о механизме образования атмосферного озона в первом приближении условимся, что в расчет берется только кислород. Кроме того, кислород и озон под влиянием коротковолнового излучения Солнца подвергаются диссоциации на атомы, которые могут вновь соединяться, образуя кислород и озон. В то же время озон может снова разлагаться и под влиянием более длинноволнового облучения. Диссоциация или ионизация молекул азота ведут к образованию атомов или ионов азота, которые могут соединяться с другими различными атомами. То же происходит и с другими газами, которые содержатся в воздухе в виде примесей. При некоторых упрощениях можно получить определенное представление о механизме образования озона в атмосфере и о том, что устанавливается равновесие образования и разложения озона.
Атомы кислорода, необходимые для образования озона, могут получаться за счет фотохимической диссоциации молекул
О2 + hv = 2О∙
При коротковолновом излучении кислород обладает громадным поглощением. Вначале он распадается на два нормальных (невозбужденных) атома (О), а затем при более коротких волнах имеет место возбуждение атомов кислорода (О*). Если считать, что скорость диссоциации молекул кислорода пропорциональна его концентрации и интенсивности облучения
На более низких высотах в атмосфере, где в солнечном спектре больше длинноволнового излучения, будет происходить разложение озона:
О3 + hv? O2 + O∙.
Еще ниже по высоте при сравнительно больших давлениях и более низких интенсивностях облучения атомы кислорода будут участвовать в тройных столкновениях. При этом озон образуется в таких количествах, что уже может начаться реакция
О3 + O∙? 2O2
С уменьшением интенсивности облучения, которая связана соответствующим образом с длиной волны света, число атомов кислорода будет быстро убывать.
В атмосфере на больших высотах концентрация озона с уменьшением высоты должна убывать из-за уменьшения концентрации третьих частиц и кислорода. Концентрация озона должна быть максимальной на высоте 25...30 км.
Роль озона в различных природных явлениях
В атмосфере существует распределение озона по времени, широте и высоте. В соответствии с суточными колебаниями послеобеденное содержание озона больше утреннего. Максимального значения содержание озона достигает весной, а осенью падает до минимума. В полярных широтах озона содержится в два раза больше, чем у экватора. Концентрация озона проходит через максимум на высоте 25 км. Она увеличивается также на высоте 70 км. С повышением широты высота озонового слоя падает с 25 км до 1 3 км.
Атомарный кислород образуется на больших высотах благодаря коротковолновому излучению. Процесс его образования распространяется вниз до 25 км высоты. На этой высоте атмосферное давление обеспечивает достаточное парциальное давление молекулярного кислорода для начала реакции образования сравнительно тяжелых молекул озона.
На более низких высотах благодаря уменьшению высокочастотного облучения и сохранению длинноволнового начинается обратный процесс. Образующиеся при этом молекулярный и атомарный кислород, будучи легче озона, поднимаются вверх. Таким образом, существует постоянный поток озона вниз. Расчеты показывают [10], что такие «озоновые осадки» достигают 3 ∙109 т в год. За период с октября по апрель солнечная радиация слабее, чем с апреля по октябрь, содержание озона весной и летом заметно уменьшается. В тропосфере, в приземном слое содержится лишь 1 0% от общего атмосферного озона. Хотя в соответствии с направлением градиента концентрации диффузия озона направлена вниз, к земле, озон, по-видимому, в потоке разлагается, так что содержание его у поверхности Земли незначительно и колеблется в проделах 20...60 мкг на 1 см. Повышенное содержание озона отмечается на берегах морей и над лесами. Интересно также отметить, что независимо от местности ночью озона всегда меньше, чем днем.
Озон имеет многочисленные полосы поглощения, простирающиеся от длинноволновой инфракрасной до коротковолновой ультрафиолетовой области. Спектр поглощения озона в ультрафиолетовой области хорошо коррелирует со спектрами поглощения нуклеиновых кислот и белков. По своему биологическому действию солнечное излучение, достигающее поверхности Земли, обычно делится на более активное, с длиной волны 2800...3150 Е, называемое УФ-А, и менее активное, с длиной волны 3150...4000 Е, называемое УФ-В. Количество ультрафиолетового излучения зависит от многих физико-химических, метеорологических, геофизических и других условий. В частности, оно зависит от широты местности, высоты над уровнем моря, прозрачности атмосферы и т. д. Годовая доза УФ-А изменяется на порядок при переходе от Арктики (360 Вт-ч/м2) к тропикам (3600 Вт-ч/м2). В небольших дозах ультрафиолетовое облучение сказывается благоприятно на человеке, животных и растительность, в частности способствует выработке в организме человека, животных и птиц витамина D, регулирующего процесс кальциевого обмена. Совершенно противоположно действие повышенных доз ультрафиолета. Под их влиянием происходит распад важнейших частей клетки. В ней возникают вещества, блокирующие процессы воспроизводства ДНК и синтеза РНК. У человека высокие дозы ультрафиолетового излучения вызывают сильные ожоги и раковые заболевания. Отмечается также отрицательное влияние повышенных доз ультрафиолета на растительный мир.
Поглощение озоном коротковолнового ультрафиолетового излучения, корреляция его с поглощением белка и нуклеиновых кислот предопределяют защитные функции озонового слоя для всего живого на Земле. В этой связи заслуживает должного внимания явление, известное под названием «парникового эффекта».
Влияние циклов различных газов на образование и разложение озона
В образовании и разрушении озона атмосферы играют существенную роль и другие компоненты воздуха, как основные, так и примесные. Рассмотрение их влияния представляет существенный интерес как с точки зрения более углубленного понимания механизма образования озона в атмосфере, так и с точки зрения влияния антропогенных факторов на концентрацию озона в атмосфере. В этом отношении большую роль играет азот как главная составная часть атмосферы. Известно около пятидесяти фотохимических реакций азота. Верхние слои атмосферы (мезосфера и термосфера) состоят из атомов и ионов азота, образующихся под действием коротковолнового излучения. Образование озона также происходит в верхних слоях атмосферы, начиная с высоты 80 км, где давление еще позволяет образование молекул при тройных столкновениях. Ниже, в стратосфере, где происходит основное образование озона, начинают играть роль оксиды азота, главным образом, в виде оксида азота (II) и оксида азота (IV). В тропосфере их содержание убывает с высотой, вероятно, вследствие взаимодействий с водяным паром, тогда как в стратосфере картина обратная: содержание оксида азота (II) и оксида азота (IV) с высотой возрастает. Согласно экспериментальным данным, на высоте 30 км концентрация оксида азота (II) после восхода солнца возрастает на два порядка. Вообще отношение общего объема окислов азота к общему объему
-1 0 -8
атмосферы изменяется от 1 0 до 1 0. Существует мнение, что разложение озона определяет в основном азотный цикл. В нем разлагается до 80% озона. Укажем лишь на некоторые стадии из этого цикла:
NO2 + O∙? NO + O2,
NO + O3? NO2 + O2,
Озон медленно реагирует с NO2 с образованием радикала NO3·
NO2 + O3? NO3· + O2, радикал быстро реагирует с NO, NO2 с образованием NO2 и N2O5
NO3 · + hv? NO + O2.
Следует отметить, что оксид азота (II) широко используется как реагент на атомарный кислород:
NO + O∙? NO2+ hv.
Это одна из немногих реакций, которая протекает с излучением желто-зеленого света. При этом интересно, что в тихом электрическом разряде, в смеси кислорода с оксидами азота (II) и (III) образования озона не происходит, и преимущественно протекают реакции и реакция
NO + O∙? NO2+ hv NO2 + O∙? NO + О2.
Нельзя, однако, не отметить, что азот может способствовать образованию озона путем своего возбуждения и дальнейшему участию в возбуждении и диссоциации молекул кислорода:
N2* + O2? N2 + О∙ +О∙
Не исключена также возможность образования на свету (длина волны 395 нм) атомарного кислорода из оксида азота (IV):
NO2 + hv? NO + О-.
Роль оксидов азота в разложении озона очень велика, и они могут оказывать весьма существенное влияние на его концентрацию в атмосфере. Из приведенных компонентов атмосферы, влияющих соответствующим образом на образование и разрушение озона, следовало бы остановиться на водяном паре, точнее, на атомарном водороде и радикале гидроксида, образующихся при разложении воды под действием солнечного излучения:
Н2О + hv → Н∙ + ОН∙.
Кроме того, вода может реагировать с атомами водорода и кислорода с образованием радикалов ОН-, играющих большую роль в разложении озона:
О∙ + Н2О →2ОН∙,
Н∙ + Н2О? Н2 + ОН∙.
Хотя водяной пар содержится главным образом в тропосфере и его проникновению в стратосферу препятствует тропопауза, являющаяся своеобразной холодной ловушкой для водяного пара, тем не менее, несконденсированные остатки воды проникают из тропосферы в стратосферу. По ориентировочным данным, через тропопаузу проходит ежегодно от 0,5 до 1,2 млрд. т водяного пара, так что объемное отношение водяного пара в стратосфере обычно колеблется от 3-10-6 до 6-10-6.

Таблица 2
Имеются основания считать, присутствующих в атмосфере, концентрацию в зависимости от что из всех приведенных в табл. 2 частиц, только О∙, Н∙ и ОН∙ имеют равновесную интенсивности солнечного облучения. Тогда, принимая, что образование атомарного водорода происходит только по реакциям
Н2О + hv → Н∙ + ОН∙ ОН∙ + О∙ > Н∙ + О2,
а его исчезновение - по реакциям
Н∙ + О2 + М∙? НО2- + М∙,
Н∙ + О3? ОН∙ + О2,
Оценочные данные показывают, что на высоте 40 км в 1 см3 содержится приблизительно 1 03 атомов водорода.
Аналогично можно поступить и в случае радикалов ОН-. Считая, что частицы ОН- образуются только по реакциям
НО2∙ + О? НО∙ + О2,
НО2∙ + О3? НО ∙ + 2О2,
а расходуются по реакциям и
ОН∙ + О3 > НО2- + О2,
Оценочные данные показывают, что содержание ОН∙ в атмосфере равно приблизительно 106 частиц в 1 см3. Судя по удовлетворительному совпадению расчетных данных для О2 и О3 с непосредственно измеренными, можно полагать, что цифры, приведенные в табл. 2, в определенном приближении отражают действительность.
Как уже отмечалось, разложение озона определяет в основном азотный цикл, В этом отношении антропогенные факторы поступления оксидов азота в атмосферу играют важную роль в загрязнении атмосферы и отрицательном влиянии на озоновый защитный слой. Один из источников их поступления -ядерный взрыв. Образование оксидов азота при ядерном взрыве происходит за счет быстрого разогрева воздуха примерно до 6000 К и затем быстрого его охлаждения. Считается, что при взрыве мощностью в 1 Мт образуется от 1 000 до 12 000 т (т. е. до 2,5-10 молекул) оксидов азота. Существенное влияние на образование оксидов в атмосфере оказывают выхлопные газы звуковых и сверхзвуковых самолетов. Вносит свой вклад в загрязнение атмосферы и растущее потребление азотных удобрений, которые под влиянием микроорганизмов генерируют оксид азота (I) (N2O). Наконец, значительное воздействие может оказать и сжигание обычного топлива, коль скоро при температурах порядка 2000.3000?С термодинамическое равновесие сдвигается значительно в сторону образования оксидов азота. За счет ежегодного сжигания топлива на планете образуется до 3 млн. т оксидов азота.
Говоря о влиянии антропогенных факторов на защитный слой озона, нельзя пройти мимо влияния хлора и его окислов, возникающих при фотолизе хлорфторметанов (фреонов). Как известно, фреоны нашли очень широкое практическое применение. Фреоны представляют собой галогенпроизводные метана, этана (С2Н6), пропана (С3Н8) с обязательным содержанием фтора: CF2CI2, CF3Cl, CF4, С2Н4Б2, С2Н2Б4 и т. д. Они очень хорошо сохраняются в атмосфере, поскольку плохо растворимы в воде и не горят, имеют, как правило, низкие температуры кипения и поэтому на воздухе хорошо испаряются. Из тропосферы часть фреонов может уходить с водой и, не гидролизуясь, скапливаться в океане. Океан является своеобразным резервуаром фреонов. По имеющимся данным, объемное отношение смеси фреонов к незагрязненному воздуху равно примерно 10-16. Фотолиз фреонов, происходящий под действием ультрафиолетового облучения, обусловливает разрыв связи С-С в фреоне и соответственно генерацию активного хлора:
CFCI3 + hv? CFCI2 + Cl∙,
CF2Cl2 + hv? CF2Cl + Cl∙.
В свою очередь, Cl∙ инициирует различные циклы взаимодействия с озоном:
Cl∙ + O3? ClO + O2,
ClO + O∙? Cl + O2,
С1О∙ + O3? ClO + 2O2,
ClO∙ + O3? ClO2 + O2,
ClО2 + O? ClO + O2.
Обрыв цепей в хлорных циклах, по-видимому, происходит за счет реакций:
Cl∙ + СН4 > НС1 + СН3,
ci∙+ > НС1 + H2О,
Cl∙ + н2 > нс1 + н∙,
Cl∙ + HО2∙ > НС1 + O2.
Вклад различных циклов разложения озона подтверждает высказанное выше предположение о том, что на озоновый слой влияет главным образом азотный цикл, тогда как галоидный цикл оказывается не столь существенным. Тем не менее, он заслуживает должного внимания. Появление озоновых дыр обеспокоило весь мир, в связи с чем производство фреонов в настоящее время запрещается или сводится к минимуму.

40 60 80 %
Вклад различных циклов в скорость разложения озона: 1 - галоидный цикл; 2 - водородный цикл; 3 - кислородный цикл; 4 - азотный цикл
Существуют и природные предшественники активного хлора, способные проникать в стратосферу. К ним относится метилхлорид (СН3С1), который выделяется в больших количествах из воды, выбрасывается вулканами, а также образуется при горении биомассы. В условиях стратосферы метилхлорид разлагается с выделением активного хлора. Его называют «резервуарным газом», поскольку он не реагирует непосредственно с озоном.
Другим резервуарным газом служит гипохлорит нитронила (C1ONO2). Он играет важную роль в объяснении феномена образования озоновой дыры над Антарктидой. Суть его заключается в том, что зимой в Южном полушарии происходит постепенное, а вначале весны более быстрое уменьшение общего содержания озона, обычно достигающее в октябре 30...50% от среднегодового. Затем в середине весны общее содержание озона в стратосфере восстанавливается до нормального уровня.
В настоящее время сложилось представление о том, что озоновая дыра возникает вследствие уникальных физико-химических процессов, протекающих в стратосфере Антарктиды. К ним прежде всего относится зимний циркумполярный вихрь, изолирующий атмосферу над Антарктидой от других частей стратосферы. Вследствие этого в зимний период в антарктическую стратосферу не поступает воздух из низких широт, и, следовательно, не восполняется убыль озона внутри вихря.
Другая особенность антарктической стратосферы заключается в аномально низкой зимней температуре (в нижних слоях в ночные часы температура обычно бывает ниже 195 К). В этих условиях образуются так называемые «полярные стратосферные облака». Зимой в экстремально холодной стратосфере резко уменьшается содержание оксидов азота и водяного пара, а стратосферные облака захватывают ледяными кристаллами один из компонентов азотного цикла -азотную кислоту. Действующие вулканы Антарктиды, прежде всего Эребус, пополняют стратосферу хлором. В обедненной оксидами азота атмосфере меньше образуется резервуарного газа ClONO2:
ClO + NO? NO2 + Cl∙
ClO + NO2∙? ClONO2
стратосфера обогащается частицами ClO, активными по отношению к озону.
Весной циркумполярный вихрь быстро разрушается на сегменты, которые дрейфуют в направлении экватора. В целом температура в стратосфере над Антарктидой резко повышается, полярные стратосферные облака исчезают, высвобождаются компоненты азотного цикла. Приток воздуха из низких широт ликвидирует дефицит озона над континентом.
Загрязнение окружающей среды (атмосфера, литосфера). Виды. Источники. Способы утилизации отходов.
ЗАГРЯЗНЕНИЕ АТМОСФЕРЫ
Классификация атмосферных загрязнений
По своим масштабам заслуживают внимания, прежде всего, три источника, как транспорт, индустрия и военно-промышленный комплекс. В среднем на долю транспорта приходится 60% общего количества загрязнений, поступающих в атмосферу, на долю промышленности - 17%, энергетики - 1 4%, на отопление и уничтожение отходов - 9%.
Атмосферные загрязнители классифицируют по пути поступления в атмосферу на первичные, поступающие непосредственно в атмосферу, и вторичные, являющиеся результатом превращения последних. Так, поступающий в атмосферу в процессе сгорания серосодержащего топлива или переработки сернистых руд сернистый газ является первичным загрязнителем атмосферы. Сернистый газ окисляется до серного ангидрида:
SO2 + О2 ? SO3,
который взаимодействует с парами воды и образует капельки серной кислоты:
SO3 + H2O? H2SO4.
При взаимодействии серного ангидрида с аммиаком и водой образуются кристаллы сульфата аммония:
SO3 + 2NH3 + H2O? (NH4)2SO4.
Серная кислота и сульфат аммония - вторичные загрязнители. Подобным образом, в результате химических, фотохимических, физико-химических реакций между загрязняющими веществами и компонентами атмосферы, образуются другие вторичные загрязнители.
Около 85% общего выброса вредных веществ в атмосферу составляют сернистый газ, окись углерода, оксиды углерода и аэрозольная пыль. Половина остальных 15% специфических вредных веществ приходится на углеводороды, другая половина - на аммиак, сероводород, фенол, хлор, сероуглерод, фтористые соединения, серную кислоту.
Аэрозоли
Опасным элементом загрязнения атмосферы являются аэрозольные образования. Аэрозоли - это дисперсные системы, в которых дисперсионной средой служит газ, а дисперсными фазами являются твердые или жидкие частицы. Обычно размеры частиц аэрозолей ограничивают интервалом 1 0-7 ∙ 1 0-3 см. Наиболее распространенные аэрозоли можно разделить на три группы. Пыль - дисперсные системы, состоящие из твердых частиц, диспергированных в газообразной среде.
Дымами являются аэрозоли, которые получаются при конденсации газа. Туман - это дисперсная система, состоящая из жидких частиц в газообразной среде.
В механизме образования аэрозолей существенную роль играют центры конденсации, сублимации, кристаллизации, обычно называемые ядрами. Для возникновения устойчивого зародыша новой фазы, например, капли жидкости в газе необходима дополнительная энергия, связанная с возникновением поверхности раздела фаз.
Седиментация, испарения, конденсация, электромагнитные поля, броуновское движение - эти самые разнообразные физические факторы способны вызывать изменения в аэродисперсной системе. Естественными источниками атмосферных аэрозолей служат вулканы и гейзеры, разрушающиеся горные породы, пылевые бури, почвенная эрозия и лесные пожары. Природные выбросы аэрозолей всегда влияли на среду человеческого обитания. Однако, уравновешиваясь общим круговоротом веществ в природе, они не вызывали глубоких экологических изменений. Антропогенные же факторы, активная деятельность ноосферы приняли такой размах, что природные круговороты, в конце концов, не могут скомпенсировать перегрузки. Достаточно сказать, что сейчас в земной атмосфере взвешено около 20 млн. т частиц, из которых примерно три четверти приходится на долю выбросов промышленных предприятий.
Основной параметр, характеризующий взвешенные частицы, - это их размер. Наиболее опасными для легких человека являются частицы от 0,5 до 5 мкм;
более крупные задерживаются в полости носа, более мелкие в дыхательных путях не оседают, и мы их выдыхаем. На аэрозольные частицы могут оказывать влияние самые различные силы: гравитационные, электрические, центробежные, звуковые, магнитные. Под действием внешних сил частицы перемещаются, как бы раздвигая на своем пути газовую среду. Ее сопротивление, эквивалентное силе трения и препятствующее движению частицы, определяется известным законом Стокса:
F = 6πnrrv,
где F - сила трения, r - радиус частицы, V - ее скорость и n - вязкость среды.
Используя закон Стокса, можно определить скорость осаждения частиц под влиянием силы тяжести (седиментации). Расчеты показывают [10], что в спокойном воздухе скорость осаждения частиц размером 1 00 мкм составляет 25 см/с, 10 мкм - 0,3 см/с, а 1 мкм - всего 0,003 см/с. Это означает, что частицы размером 1 00 мкм при высоте источника выброса 10 м осядут за 40 с, а размером в 1 мкм -лишь за 93 ч. Результаты этого простого расчета показательны с двух точек зрения. Медленное оседание аэрозолей предопределяет изменение прозрачности воздуха со всеми вытекающими отсюда последствиями, и обратно: быстрое их оседание может отрицательно сказаться на зеленом покрове Земли.
Загрязнение атмосферы автотранспортом
Наибольшее количество загрязнителей поступают в атмосферный воздух от подвижных энергетических установок, работающих на углеводородном топливе (бензин, керосин, дизельное топливо, мазут, уголь, природный газ и др.). Количество загрязнения определяется составом, объемом сжигаемого топлива и организацией процесса сгорания.
В атмосферу выбрасываются оксид углерода (II), оксиды серы, азота, соединения свинца, сажа, углеводороды, в том числе канцерогенный бенз(а)пирен (С20Н12), несгоревшие частицы топлива. В тоже время известно что концентрация углекислого газа остается постоянной в атмосфере на протяжении многих миллионов лет. Так же известно что искусственное повышение концентрации углекислого газа увеличивает фотосинтез т. е. его связывание. Поэтому в настоящее время отнесение углекислого газа к парниковым газам Земли пересматривается. Возможно большую опасность несут пары воды в стратосфере образующиеся при полетах самолетов.
При работе двигателя на бензине в выхлопах появляются окислы азота. Количество свинца в воздухе находится в прямой зависимости от интенсивности движения и может достигать 4. 1 2 мг/м2. При работе на серосодержащем топливе в выхлопах появляется также SO2. Как правило, содержание токсичных веществ в выхлопе бензиновых и дизельных двигателей превышает предельно допустимые концентрации в десятки и сотни раз. Тысяча автомобилей с карбюраторным двигателем в день выбрасывает около 3 т угарного газа, 100 кг оксидов азота, 500 кг соединений неполного сгорания бензина.
В идеальном случае при сгорании топлива должны получаться только углекислый газ и пары воды. Однако, из-за неполного сгорания (и разного рода добавок в частности повышающих октановое число) образуются различные химические вещества, например:формальдегид, метанол, угарный газ.
В результате фотохимических превращений смеси углеводородов, образующихся при неполном сгорании топлива и оксидов азота, поступивших в воздух в результате автомобильных выбросов, возможно образование фотохимического смога. Смог - это туман с влажностью около 70%. Образующие фотохимический смог вещества значительно превышают по своей токсичности исходные атмосферные загрязнения.
Фотохимический смог сопровождается неприятным запахом, резко снижается видимость, у людей воспаляются глаза, слизистые оболочки носа и горла, возникает удушье, обостряются легочные заболевания, бронхиальная астма. Фотохимический смог повреждает и растения. Сначала на листьях появляется водянистое набухание, через некоторое время нижние поверхности листьев приобретают серебристый или бронзовый оттенок, а верхние становятся пятнистыми с белым налетом. Затем наступает быстрое увядание растения.
Фотохимический смог вызывает коррозию металлов, растрескивание красок, резиновых изделий, портит одежду, нарушает работу транспорта.
Основной причиной фотохимического смога являются отработанные газы. В утренние часы «пик» в воздухе с влагой накапливается достаточно большое их количество. Во второй половине дня под действием усиливающего нагрева инверсия ослабевает, смог поднимается вверх
Многие виды топлива содержат связанный азот. В реакционной зоне пламени могут происходить превращения по схеме
Трехвалентный азот N —► HCN — NHx или NOх или N2
Образовавшийся молекулярный азот при температуре может вступать в реакцию взаимодействия с кислородом, сопровождающуюся образованием оксида азота (II): N2 + O2? 2NO. На каждом километре пути легковой автомобиль выделяет около 10 г оксида азота (II). Оксид азота (II) может окисляться до оксида азота (IV):
2 NO + O2? 2NO2,
который под действием солнечного излучения расщепляется с образованием атомарного кислорода:
NO2 ? NO + Ov
Атомарный кислород, взаимодействуя с кислородом воздуха, образует молекулу озона:
O∙ + О2? O3.
Молекулы озона могут взаимодействовать с оксидом азота (II):
O3 + NO > NO2 + O2.
 Далее вновь возникают циклические реакции, в итоге в атмосфере образуется избыток озона. Озон вступает в реакции с непредельными углеводородами, и образуются продукты окисления (оксиданты), представляющие собой органические пероксидные соединения, - характерные составляющие фотохимического смога. При этом протекают следующие реакции:
Далее вновь возникают циклические реакции, в итоге в атмосфере образуется избыток озона. Озон вступает в реакции с непредельными углеводородами, и образуются продукты окисления (оксиданты), представляющие собой органические пероксидные соединения, - характерные составляющие фотохимического смога. При этом протекают следующие реакции:
Для снижения вредных выбросов в выхлопных трактах автомобилей устанавливают нейтрализаторы в основе действия которых лежит использование термокаталитических реакций с участием кислорода. В США нейтрализаторы снизили суммарный выброс токсичных веществ автотранспортом с 76 млн. т в 1997 году до 55 млн. т в 2002 году. В частности для этих целей автомобильная промышленность США закупила в 1974 г. 11 тонн платины – почти столько же, сколько химическая и нефтеперерабатывающая отрасли, вместе взятые, но этот дорогой и дефицитный материал не может применяться широко. В тоже время Россия добывает треть мировой добычи приблизительно от 180 тонн в год.
Испытания семейства каталитических нейтрализаторов, разрабатываемых в нашей стране, показали, что они снижают уровень содержания угарного газа в выхлопах на 80%, углеводородов - на 70%, оксида азота (II) - на 50%. В целом токсичность выброса уменьшается в 10 раз.
В двухступенчатых каталитических нейтрализаторах отработавшие газы проходят последовательно через два слоя катализаторов. Сначала через пористые восстановители (восстановительный катализатор), в качестве которых используются сплав меди и никеля, при этом происходит восстановление оксида азота (II):
NO + CO Cu, Ni→ N2+ CO2
NO + Н2 Cu, Ni→ N2+ H2O
Затем на другом катализаторе (окислительный катализатор) в окислительной среде, для создания которой в нейтрализатор дополнительно вводится воздух, происходит окисление таких продуктов неполного сгорания, как угарный газ и углеводороды:
CO+0,5O2 Рt→ CO2,
CxHy + O2 Рt→ CO2 + H2O.
Платина является наилучшим окислительным катализатором, для дожигания и обезвреживания выхлопных газов. Предпринятые поиски более дешевых и доступных катализаторов показали, что платину можно заменить палладием (Pd), рутением (Ru), а также оксидом меди (II) (CuO), оксидом хрома (II) (CrO), оксидом никеля (II) (NiO), оксидом марганца (IV) (MnO2), а в нейтрализаторах российского производства используется оксид алюминия (Al2O3).
Очистка аэрозолей
Основные принципы выбора наиболее широко используемого оборудования неизменны. Так циклоны обычно используются в тех случаях, когда пыль крупнодисперсная, ее концентрация превышает 2 г/м3 и не требуется высокой эффективности улавливания. Скрубберы мокрого типа целесообразно использовать, если мелкие частицы должны улавливаться с относительно высокой эффективностью, желательно охлаждение газа, а повышение его влажности не служит препятствием, если газы представляют опасность в пожарном отношении и необходимо улавливать как твердые, так и газообразные вещества. Тканевые фильтры используются в тех случаях, когда необходима очень высокая эффективность улавливания, температура относительно низка. Электрофильтры применяют, если для улавливания мелких частиц необходима высокая эффективность, обработке подлежат очень большие объёмы газа и необходимо утилизировать ценные продукты.
ЛЕКЦИЯ № 4. Ионизирующее излучение (2 часа).
Цели:
1.Систематизация теоретических знаний о видах, действии физических излучений
2.Формирование представлений о механизмах радиоактивного распада ии его роли в существовании, эволюции биосферы
3. способностью организовывать сотрудничество обучающихся, поддерживать активность и инициативность, самостоятельность обучающихся, их творческие способности» (ПК-7).
Содержание
Единицы измерения. Виды доз. Биологическое действие. Законы радиоактивного распада. Антропогенные источники ионизирующего излучения
Интерактивная форма: Эвристическая беседа о биологической опасности радиации
Уран широко распространён в природе; в значительных концентрациях он обнаружен во многих горных породах, в океанах, а также в лунных породах и метеоритах. В земной коре его больше, чем серебра, висмута, кадмия или ртути (по распространенности он занимает 38-е место), но он находится главным образом в рассеянном состоянии.
Имеется ряд причин для предположения, что большая часть урана концентрируется в земной коре, а не распределена равномерно по всей массе нашей планеты. Земля постоянно излучает тепло, выделяющееся при распаде урана, тория и 40К. Если бы в Земле присутствовал однородно распределённый уран с такой большой концентрацией как 2⋅10-4, то количество выделяемого тепла было бы достаточным для непрерывного повышения температуры Земли. Однако, геологические данные свидетельствуют, что температура земной поверхности никогда не имела значительных колебаний. На основе расчёта теплового баланса Земли в земной коре находится от 35 до 100% всего урана, а среднее его содержание в мантии Земли плюс земной коре изменяется от 1,6.10-6 до 5,2·10-6% в зависимости от модели расчётов. Приведённый интервал абсолютной распространённости урана согласуется с оценками для звёздного нуклеосинтеза.
Установлено также заметное обогащение урана в породах земной коры, особенно в большинстве кислых пород, входящих в состав континентов. Этот вывод подтверждается кристаллографическими данными, указывающими, что уран не может включаться в кристаллические решётки сильоносновных пород, расположенных на больших глубинах.
Уран – характерный элемент для гранитного слоя и осадочной оболочки земной коры. Среднее содержание урана в земной коре (кларк) 2,5·10-4% по массе (2-4 ppm в зависимости от региона), в кислых изверженных породах 3,5·10-4%, в глинах и сланцах 3,2·10-4%, в основных породах 5·10-5%, в ультраосновных породах мантии 3·10-7%. Количество урана в слое литосферы толщиной 20 км оценивают в 1.3⋅1014 т. Он входит в состав всех пород, слагающих земную кору, а также присутствует в природных водах и живых организмах. Мощных месторождений не образует. Основная масса урана содержится в кислых, с высоким содержанием кремния, породах. Наименьшая концентрация урана имеет место в ультраосновных породах, максимальная – в осадочных породах (фосфоритах и углистых сланцах). В океанах содержится 1010 т урана. Концентрация урана в почвах варьируется в интервале 0,7 – 11 ppm (15 ppm в сельскохозяйственных почвах, удобряемыми фосфорными удобрениями), в морской воде 0,003 ррm.
Кларки урана в горных породах
Магматические породы
ультраосновные 0,003⋅10-4
основные 0,5⋅10-4
средние 1,8⋅10-4
кислые 3,5⋅10-4
щелочные до 80⋅10-4
Осадочные породы
известняки 1,3⋅10-4
песчаники 2,0⋅10-4
глинистые сланцы 3,4⋅10-4
углистые сланцы 1,4-80⋅10-4
фосфориты 245⋅10-4
Некоторые типичные концентрации урана в различных средах приведены ниже (ppm - промилле, одна миллионная часть).
Концентрация урана в различных природных средах
Богатые руды (Канада) – 20%U 200000 ppm U
Средние руды – 2%U 20000 ppm U
Бедные руды – 0,1%U 1000 ppm U
Очень бедные руды (Намибия)– 0,01%U 100 ppm U
Гранит 4 ppm U
Континентальные разломы 2,8 ppm U
Скальные породы 2 ppm U
Среднее количество в земной коре 1.4 ppm U
Морская вода 0.003 ppm U
Среднее содержание урана в почвах по сравнению с составом литосферы.
В атомн.% В вес. %
В литосфере 2⋅10-5 3⋅10-4
В почвах 9⋅10-6 1⋅10-4
При кристаллизации магматических пород уран отжимается в остаточный расплав и
сосредотачивается в акцессорных минералах. Близость ионного радиуса U4+ к ионным радиусам Th, Ca, определяет широкий спектр изоморфных замещений урана в ториево-редкоземельных минералах. В гидротермальном процессе уран активно мигрирует в виде уран-карбонатных комплексов. При понижении окислительно-восстановительного потенциала растворов, падении парциального давления углекислоты, изменении pH растворов происходит разрушение этих комплексов и выпадение урана в виде минеральных фаз. Температурные интервалы образования гидротермальных урановых минералов оценивается в 100-220о, иногда 300-350о. Процессы метаморфизма от амфиболитовой до гранулитовой фракции обычно сопровождаются выносом урана. При ультраметаморфизме возможен его некоторый привнос. В экзогенных процессах уран способен мигрировать в кислородсодержащих водах и переходить в твердую фазу при смене окислительно-восстановительной обстановки (геохимический барьер).
Уран энергично мигрирует в холодных и горячих, нейтральных и щелочных водах в форме простых и комплексных ионов, особенно в форме карбонатных комплексов. Важную роль в геохимии урана играют окислительно- восстановительные реакции, поскольку соединения урана хорошо растворимы в водах с окислительной средой и плохо растворимы в водах с восстановительной средой (например, сероводородных).
Вода океанов, содержащая 3,5% солей, имеет около 2⋅10-6 гU/л (2⋅10-9 г/г). Полное содержание урана в океанах составляет 4⋅109 т, или 0,003 вес.% количества его в земной коре. В морской воде содержание урана находится в пределах 0.36⋅10-6-2,3⋅10-6 г/л. При содержании в океанической воде карбонат-иона больше чем n⋅10-6 н. (рН>7,5 при РСО2=5⋅10-4 атм). Уран находится в океанической воде в виде комплекса [UO2(CO3)3]4-. В этом состоянии он не способен в значительных количествах переходить в донные отложения. При содержании карбонатного иона в океанической воде, меньшем n⋅10-6 н. (рН<7,5 при РСО2=5⋅10-4 атм), уран находится в океанической воде в форме продуктов гидролиза, адсорбированных на кремний содержащих коллоидных частицах. При этом уран уходит на дно со скоростью, определяемой скоростью седиментации частиц, на которых он адсорбирован. В поверхностном слое Баренцова моря концентрация урана равна 1,6⋅10-6 г/л, Чёрного моря - 2,9⋅10-6 г/л. Концентрация урана в водах рек европейской части России находится в пределах (0,15-3,3)⋅10-6 г/л, в реках азиатской части России (0,2-10,0)⋅10-6 г/л, В озёрах России концентрация урана находится в пределах (0,15-15,2)⋅10-6 г/л, а концентрация урана некоторых подземных водах России, не связанных с урановыми месторождениями, - в пределах (0,2-120)⋅10-6 г/л.
В ходе геологической истории содержание урана в земной коре уменьшилось за счёт радиоактивного распада; с этим процессом связано накопление в земной коре атомов Рb и Не. Радиоактивный распад урана играет важную роль в энергетике земной коры, являясь существенным источником глубинного тепла. Из-за большого периода полураспада, урановое тепло выделяется медленно, но оно существенно подогревает Землю (в основном – её верхний слой).
Минералы урана
В свободном виде уран в земле не встречается. Известно 100 минералов урана с содержанием U более 1%. Примерно в одной трети этих минералов уран четырёхвалентен, в остальных – шестивалентен. 15 из этих урановых минералов являются простыми оксидами или гидроксилами, 20 – комплексными титанатами и ниобатами, 14 – силикатами, 17 – фосфатами, 10 – карбонатами, 6 – сульфатами, 8 – ванадатами, 8 – арсенатами. Неопределённые формы урановых соединений встречаются в некоторых углистых сланцах морского происхождения, лигните и угле, а также в межзёрновых плёнках в изверженных породах. Промышленное значение имеют 15 минералов урана.
Название Формула Содержание урана, %
Уранинит (U,Th)O2x 2-85, Настуран UO2x 52-76, Урановые черни UO2x 11-53, Коффинит U(SiO4)1-x (OH)4x 60-70, Браннерит (U,TH)Ti2O6 35-50.
В некоторых типах месторождений основным носителем урана является ураноносный
фторапатит, в котором уран изоморфно замещает кальций.
Главные урановые минералы в крупных рудных месторождениях представлены оксидами
(урановая смолка, уранинит, коффинит), ванадатами (карнотит и тюямунит) и комплексными титанатами (браннерит и давидит). Промышленное значение имеют также титанаты, например, браннерит UTi2O6, силикаты - коффинит U[SiO4]1-x(OH)4x, танталониобаты и гидритированные фосфаты и арсенаты уранила -урановые слюдки. Уран не встречается в природе как самородный элемент. Вследствие того, что уран может находиться в нескольких стадиях окисления, он встречается в весьма разнообразной геологической обстановке.
Минералы урана делят на первичные, образовавшиеся при формировании земной коры, и
вторичные – те, что образовались на более поздних стадиях ее развития под действием тех или иных природных факторов. Урановые минералы образуются на всех стадиях эндогенного минералообразования.
Концентрации урана, превышающие в 10 раз среднее содержание урана в земной коре, т.е. 0,003%, образуются в результате магматической деятельности и процессов седиментации, а также в результате процессов рудообразования. Повсеместное присутствие урана объясняется его физическими и химическими свойствами, в частности, многовалентностью, большим атомным радиусом, высокой химической активностью, относительной растворимостью его шестивалентных соединений в водных растворах и его относительно большим распространением по сравнению с некоторыми другими металлами.
Эти свойства дают урану возможность образовывать соединения со многими другими элементами, входить в структуру большого количества разнообразных минералов, принимать участие в образовании многих пород и минералов различного происхождения и состава. Свойства, которые обусловливают широкое распространение урана в природе, вызывают в то же время его распыление, поэтому концентрации урана не так велики, как концентрации других столь же распространённых, но менее активных металлов, например свинца и молибдена.
Минералы подразделяются на соединения 4-валентного и 6 – валентного урана (соли уранила).
Минералы группы U4+ (всегда содержащие некоторое количество U6+) представлены оксидом урана UO2 – уранинитом и его силикатом - U(SiO4)1-x(OH)4x.- коффинитом. Уранинит UO2 и настуран U3O8 – одна минеральная фаза переменного состава UOх, где х изменяется от 2 до 2,6. Обманкой этот минерал называют за переменчивость цвета: темно-серый, черный, зеленовато-черный. А смолкой – за то, что его зерна действительно похожи на капли застывшей смолы. Настуран (разновидность уранинита) и коффинит - главные промышленные минералы гидротермальных и экзогенных месторождений урана; уранинит, кроме того, встречается в пегматитах и альбититах. Порошковатые оксиды (урановые черни) и гидрооксиды урана образуют существенные скопления в зонах окисления различных урановых месторождений. Титанаты урана (бранерит UTi2O6 и др.) известны в пегматитах, а также в некоторых гидротермальных месторождениях. Вторая группа объединяет минералы, содержащие U6+, это гидроксиды (беккерелит 3UO3⋅3H2O, кюрит 2PbO⋅5H2O 3⋅5H2O), силикаты (уранофан Ca(H2O)2U2O4(SiO4)⋅3H2O, казолит
Pb [UO2][SiO4]⋅H2O), фосфаты (отенит Ca [UO2]2[PO4]2⋅8H2O, торбернит Cu[UO2]2[PO4]2⋅12H2O), арсенаты (цейнерит Cu [UO2]2[HSO4]2⋅12H2O), ванадаты (карнотит K2[UO2][VO4]2⋅3H2O), молибдаты (иригинит), сульфаты (уранопилит), карбонаты (ураноталит); все они распространены в зонах окисления урановых месторождений.
Уранинит – массивный минерал, смоляного вида, имеющий шаровидную или чашеобразную поверхность, образован смесью UO2, UO3, PbO с примесью Ra, Th, Ce, La или Er. (Сам минерал - диоксид урана UO2, но в рудах часть урана окислена до U6+, состав некоторых разновидностей - вторичных продуктов типа урановых черней - приближаются к U3O8. В руде содержит многочисленные, но в незначительном количестве, примеси других элементов, а радиогенный свинец, торий, иттрий и лантаноиды - до 20% и более. Характерно присутствие радия и гелия. Различают две разновидности первичного уранинита: кристаллическую - собственно уранинит - и более распространенную плотную, аморфную - настуран (синоним - урановая смолка, или смоляная обманка). Кристаллизуется в кубической сингонии, образуя кристаллы в форме кубов, реже в комбинации с ромбододекаэдром или октаэдром. Более обычны массивные сплошные агрегаты. Для настурана характерны плотные колломорфные выделения, почковидные и тонкосферолитовые агрегаты; для урановых черней - сажистые и порошковатые налеты и примазки, землистые массы. Образует плотные массы, выполняющие прожилки, и имеет шаровидную или чашеобразную поверхность. Очень редко кристаллизуется в форме октаэдров или кубов. Цвет черный, блеск смоляной, цвет черты черный с буроватым или зеленоватым оттенком. Обычно непрозрачен, излом раковистый, спайность отсутствует, твёрдость 6-7, плотность чистого свежего уранинита 10,6. Перед паяльной трубкой не плавится. Порошок, смешанный с содой, при прокаливании на древесном угле дает желтый налет. Разлагается в горячей концентрированной азотной кислоте. Кристаллический уранинит встречается как акцессорный минерал в гранитах и в гранитных пегматитах, где иногда образует крупные кристаллы. Он может присутствовать также в грейзенах с вольфрамитом и молибденитом. В гидротермальных месторождениях, тем более в крупных скоплениях, редок (Шинколобве, Конго). Напротив, настуран - типичный минерал гидротермальных жил; он характерен также для гидротермально-метаморфогенных месторождений - золото- и ураноносных конгломератов типа Витватерсранда (Трансвааль, ЮАР), инфильтрационных пластообразных месторождений типа плато Колорадо (США) и экзогенных: осадочных (в том числе связанных с угленосными отложениями) и эпигенетических (в зонах пластового окисления типа Уч-Кудука в западном Узбекистане). Крупнейшие в мире запасы настурановых руд сосредоточены в Канаде, Австралии и ЮАР; за ними следуют Конго, Намибия, США (Мэрисвейл, Юта; плато Колорадо) и пограничный район Германии и Чехии (Рудные горы), а также Украина и Казахстан. В России уранинит в пегматитах известен в Карело-Кольском регионе, настуран - в гидротермальных месторождениях в Забайкалье. Ранее использовался для приготовления урановых красителей, позднее - для извлечения радия при изготовлении лечебных препаратов, в настоящее время является важнейшим сырьем для получения атомной энергии. Широко применяется в биологии, медицине, металлургии и других отраслях промышленности. Уранинит и особенно настуран - главные рудные минералы урана. Вплоть до 1940 уранинит добывали (главным образом из пегматитов) в первую очередь с целью извлечения радия. Во время Второй мировой войны и особенно в послевоенный период уранинит, настуран и другие радиоактивные руды стали разрабатывать как сырье для атомной энергетики и производства ядерного оружия.
Настуран (от греч. nas t- уплотнённый и лат. uranium – уран, в сочетании с химическим составом, синонимы названы по смоляному блеску), урановая смоляная руда, урановая обманка, разновидность уранинита. Обычно настурану приписывают формулу U3O8, но в действительности состав настурана переменен, и более точной представляется формула UO2,25. Обманкой этот минерал называют за переменчивость цвета: темно-серый, черный, зеленовато-черный. А смолкой – за то, что его зерна действительно похожи на капли застывшей смолы. Представляет собой массивные агрегаты, содержащие переменные количества UO3 (преобладает) и UO2.
В 1898 году супруги Кюри смогли выделить из пехбленде, добытого в месторождении Иоахимстали (Чехия), элементы полоний и радий. Эта находка сделала настуран объектом исследований самых передовых и мощных лабораторий того времени и превратила его в один из самых важных минералов современности.
Торбернит (медный уранит, урановая слюдка), Cu(UO2)[PO4]2·nН2О, назван в честь Торберна Олофа Бергмана – шведского химика и минералога. Сингония тетрагональная, тонкотабличные, листоватые кристаллы, нередко землистые массы, почти всегда в срастании с отенитом, блеск стеклянный, на плоскостях спайности перламуторный. Растворяется в НNО3, при добавлении аммиака раствор окрашивается в синий цвет (присутствие меди), при этом выпадает желтый осадок Месторождения: ЮАР, Волк-Остров на Онежском озере и др.
Часто урану в минералах сопутствуют другие полезные элементы – титан, тантал, редкие
земли. Поэтому естественно стремление к комплексной переработке урансодержащих руд.
Английский физик Ф.Астон еще в 1913 г. разделял изотопы методом газовой диффузии. Он предложил электромагнитный метод: ионизованные атомы отклоняются электрическим или магнитным полем, а величина отклонения зависит от массы. В 1919 г. Астон сконструировал первый масс-спектрограф, который свел проблему к простой лабораторной операции, и произвел революцию в исследовании изотопов. Астон выяснил почти все об изотопах. Он открыл и изучал большое число стабильных изотопов. Все опытные факты, полученные в лаборатории Резерфорда, относились к радиоактивным элементам, поэтому необходимо было получить подтверждение, что и нормальные атомы устроены аналогично.
Первое искусственное расщепление ядра атома было осуществлено в лаборатории Резерфорда в Кембридже. Он изучал столкновение 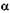 -частиц с легкими атомами. От таких ударов частицы ускорялись: ядро водорода, например, увеличивало свою скорость в 1,6 раза, на что оно отбирало у частицы 64 % ее энергии. Такие ускоренные ядра наблюдал в 1914 г. Марсден. Первая мировая война затормозила эти исследования, и лишь в 1919 г. Резерфорд стал облучать азот α-частицами, наблюдая появление однозарядных ионов водорода, названных Марсденом протонами. Их получалось очень мало: на миллион α -частиц — 20 протонов. Кроме протонов Резерфорд получил и изотоп кислорода с массой 17.
-частиц с легкими атомами. От таких ударов частицы ускорялись: ядро водорода, например, увеличивало свою скорость в 1,6 раза, на что оно отбирало у частицы 64 % ее энергии. Такие ускоренные ядра наблюдал в 1914 г. Марсден. Первая мировая война затормозила эти исследования, и лишь в 1919 г. Резерфорд стал облучать азот α-частицами, наблюдая появление однозарядных ионов водорода, названных Марсденом протонами. Их получалось очень мало: на миллион α -частиц — 20 протонов. Кроме протонов Резерфорд получил и изотоп кислорода с массой 17.
Первую ядерную реакцию с искусственным превращением элементов осуществили в 1921 г. Резерфорд и Дж.Чедвик из ядер азота получили ядра изотопа кислорода при бомбардировке α -частицами.
Искусственные радиоактивные элементы открыли И.Кюри, дочь П. и М.Кюри, и ее муж, Ф.Жолио (1934). Годом раньше они установили, что при бомбардировке α -частицами некоторых легких элементов возникают позитроны, испускающиеся и после реакции. Из энергетических соображений сначала α -частица захватывается ядром алюминия с мгновенным испусканием нейтрона и образованием радиоактивного атома (изотопа фосфора с атомной массой 30), затем этот нестабильный атом (названный радиофосфором) распадается с испусканием позитрона и превращается в уже устойчивый изотоп кремния. Этот новый вид радиоактивности, помимо -лучей, сопровождался испусканием античастиц — позитронов. Так им «удалось впервые с помощью внешнего воздействия вызвать у некоторых ядер радиоактивность, которая сохраняется в течение измеримого времени в отсутствие вынуждающей причины». Появились новые изотопы, которые до этого в природе не наблюдались. Открытие искусственной радиоактивности имело большое значение для науки и нашло огромное применение в биологии и практической медицине. К настоящему времени из 2000 радиоактивных изотопов только 300 имеют естественное происхождение.
-лучей, сопровождался испусканием античастиц — позитронов. Так им «удалось впервые с помощью внешнего воздействия вызвать у некоторых ядер радиоактивность, которая сохраняется в течение измеримого времени в отсутствие вынуждающей причины». Появились новые изотопы, которые до этого в природе не наблюдались. Открытие искусственной радиоактивности имело большое значение для науки и нашло огромное применение в биологии и практической медицине. К настоящему времени из 2000 радиоактивных изотопов только 300 имеют естественное происхождение.
Опыты по бомбардировке нейтронами ядер тяжелых элементов проводил Ферми. За одно лето 1934 г. он облучил 60 элементов и получил 40 радиоактивных продуктов. Выяснилось, что при захвате ядрами медленных нейтронов могут образовываться радиоактивные изотопы тех же или последующих элементов. Так, при облучении урана найдены изотопы нескольких веществ с периодами полураспада 10 с, 40 с, 13 мин и 100 мин. Ферми отметил, что последние два не являются изотопами элементов между номерами 82 и 92. Так были открыты трансурановые элементы. К 1939 г. было получено около 400 новых радиоактивных веществ. Кроме того, Ферми отметил, что эффективнее действуют «замедленные» (или тепловые) нейтроны, предварительно прошедшие через воду или парафин. Эту кажущуюся парадоксальной ситуацию Ферми объяснил с позиций волновой механики. Ферми собрал группу своих учеников, и они облучили нейтронами 63 элемента, из которых для 37 было установлено явление искусственной радиоактивности.
26 января 1939 г. Бор сообщил об открытии деления урана на конференции в Вашингтоне, 30 января в Парижской Академии наук об этом же сообщил Ф. Жолио, а 20 февраля он продемонстрировал эффект «взрыва», заснятого в камере Вильсона.
Вскоре было обнаружено, что при делении урана появляются свободные нейтроны, которые, попадая в ядро урана, могут вызвать новый процесс деления. Появились и теоретические работы, в которых формулировались конкретные условия для получения ядерной взрывной реакции деления. Наиболее значительных результатов в этом направлении достигли физики-теоретики Я. Б. Зельдович и Ю. Б. Харитон (ученики Н. Н. Семенова), впервые осуществившие расчет цепной реакции деления урана.
Открытие деления урана ознаменовало начало эры ядерной физики. После того как удалось расщепить ядра урана и плутония, сумели добиться быстрого и интенсивного высвобождения энергии, необходимой для взрыва атомной бомбы.
В ядерном топливе заключена огромная концентрация энергии; для сравнения — для обеспечения работы ТЭЦ мощностью 1 млн кВт необходимо расходовать около 4 — 5 млн т угля в год, а для запуска АЭС с реактором ВВЭР-1000 при той же мощности нужно загрузить в реактор примерно 70 г ядерного топлива, меняя в год около 23 г. Хотя мощность этой первой в мире атомной станции была невелика, она явилась хорошей школой для подготовки специалистов по атомной энергетике, а опыт ее безаварийной работы позволил развернуть широкое строительство мощных атомных станций с различными типами реакторов. Так теоретические исследования были воплощены в технологии, укрепили политическое положение страны, обеспечили энергетику. С использованием атомной энергии стали работать и разнообразные транспортные средства.
В 1956 г. на судоверфи адмиралтейского завода в Ленинграде был заложен атомный ледокол «Ленин» с ядерной энергетической установкой, который начал навигацию весной 1960 г. Впоследствии атомные энергетические установки были с успехом использованы на ледоколах «Арктика», «Сибирь», контейнеровозе «Севморпуть» и других, а затем и на атомных подводных лодках, составлявших гордость советских ВМС. В 1958 г. был объявлен первый советский односторонний мораторий на испытание атомного оружия, начала работу экспериментальная термоядерная установка «Огра». В 70-е годы был запущен первый в мире термоэмиссионный реактор-преобразователь «Топаз-1». А разработанные изотопные генераторы и плазменные двигатели успешно работали на космических аппаратах «Космос-34», «Космос-90», «Зонд-2», «Луноход-1», «Луноход-2» и др. В 1975 г. была проведена первая в мире операция по вживлению в организм радиоизотопного кардиостимулятора. Была запущена импульсная термоядерная установка «Ангара» (1983) и термоядерная установка «Токамак» (1988).
Га́мма-излуче́ние (гамма-лучи, γ-лучи) — вид электромагнитного излучения с чрезвычайно малой длиной волны — < 5×10−3 нм и, вследствие этого, ярко выраженными корпускулярными и слабо выраженными волновыми свойствами.
Гамма-квантами являются фотоны с высокой энергией. Считается, что энергии квантов гамма-излучения превышают 105 эВ, хотя резкая граница между гамма- и рентгеновским излучением не определена. На шкале электромагнитных волн гамма-излучение граничит с рентгеновским излучением, занимая диапазон более высоких частот и энергий. В области 1-100 кэВ гамма-излучение и рентгеновское излучение различаются только по источнику: если квант излучается в ядерном переходе, то его принято относить к гамма-излучению; если при взаимодействиях электронов или при переходах в атомной электронной оболочке — к рентгеновскому излучению. С точки зрения физики, кванты электромагнитного излучения с одинаковой энергией не отличаются, поэтому такое разделение условно.
Гамма-излучение испускается при переходах между возбуждёнными состояниями атомных ядер (см. Изомерный переход, энергии таких гамма-квантов лежат в диапазоне от ~1 кэВ до десятков МэВ), при ядерных реакциях (например, при аннигиляции электрона и позитрона, распаде нейтрального пиона и т.д.), а также при отклонении энергичных заряженных частиц в магнитных и электрических полях.
Гамма-излучение было открыто французским физиком Полем Виллардом в 1900 году при исследовании излучения радия.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2214; Нарушение авторских прав?; Мы поможем в написании вашей работы!