
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория электролитической диссоциации Аррениуса
|
|
|
|
Электролиты.
Лекция 9. Растворы электролитов.
Электролиты. Теория электролитической диссоциации Аррениуса. Степень электролитической диссоциации. Особенности растворов электролитов. Степень и константа диссоциации. Слабые электролиты. Активность и коэффициент активности. Ионное произведение воды. Водородный показатель. Произведение растворимости. Гидролиз солей. Различные случаи гидролиза. Степень и константа гидролиза.
Известно, что одни вещества проводят электрический ток, а другие не проводят. Вещества, которые распадаются на ионы и проводят электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и ток не проводят, называются неэлектролитами.
Электролит проводит электрический ток в результате того, что направленное перемещение его ионов создает поток электрических зарядов. Таким образом, пропускание электрического тока через электролит сопровождается переносом вещества.
Электролитами являются кислоты, основания и соли, находящиеся в расплавленном состоянии или в водном растворе.
Способность электролитов проводить электрический ток называется электролитической проводимостью. Она отличается от электронной проводимости металлов или других проводников электрического тока. В веществах с электронной проводимостью поток заряда обусловлен движением электронов. Поэтому пропускание электрического тока через проводники с электронной проводимостью не сопровождается переносом вещества.
Электролиты – это проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает электрический ток.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
|
|
|
Для объяснения особенностей водных растворов электролитов шведским химиком С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. Основные положения теории следующие:
1. Электролиты при растворении в воде распадаются на ионы – положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Среди таких ионов встречаются простые, например, Na+, Mg2+, Al3+ и сложные, состоящие из нескольких атомов, например, NO3-, SO42-, PO43-. В растворе ионы беспорядочно передвигаются в различных направлениях.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Первые называются катионами, а вторые анионами.
3. Диссоциация – обратимый процесс. Одновременно с распадом молекул на ионы протекает обратный процесс – соединения ионов в молекулу.
Поэтому в уравнениях электролитической диссоциации стоит не знак равенства, а знак обратимости ↔. Например, уравнение диссоциации молекулы электролита КА на катион К+ и анион А- записывается в виде
КА  К+ + А- (1).
К+ + А- (1).
Теория электролитической диссоциации полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Степень диссоциации электролитов
Под степенью диссоциации электролита понимается отношение числа диссоциированных на ионы молекул n к общему числу молекул растворенного электролита N, то есть
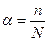 (2).
(2).
В зависимости от степени диссоциации различают слабые и сильные электролиты. Сильные электролиты при больших концентрациях диссоциированы более чем на 1/2. Степень диссоциации слабых электролитов очень мала по сравнению с 1. Сильные электролиты – это большинство нейтральных солей, сильные кислоты (НСl, HClO4, H2SO4), сильные основания (NaOH, KOH). Слабые электролиты – это большинство органических кислот, неорганические слабые кислоты и слабые основания, некоторые нейтральные соли CdCl2, Fe(CH3COO)3. Особенно слабыми электролитами являются вода, сероводород, синильная и борная кислоты.
|
|
|
Между сильными и слабыми электролитами существует переходная группа, которую образуют соли тяжелых металлов, а также некоторые сильные органические кислоты: лимонная, щавелевая, муравьиная.
Степень диссоциации зависит от природы электролита и растворителя, а также от концентрации электролита. С уменьшением концентрации степень диссоциации увеличивается, а при сильном разведении раствора, а →1, и различия между сильно и слабодиссоциирующими электролитами сглаживаются.
Степень диссоциации зависит и от диэлектрической проницаемости растворителя ε. Чем больше диэлектрическая проницаемость, тем сильнее диссоциирует электролит. В воде электролитическая диссоциация может быть сильной, а в ацетоне и в особенности бензоле – слабой. Диэлектрическая проницаемость ε воды, ацетона и бензола соответственно равна 80, 21 и 2,3. Эта закономерность, установленная Нернстом и Томсоном в 1893 г., объясняется тем, что, согласно закону Кулона, сила притяжения между разноименно заряженными ионами обратно пропорциональна диэлектрической проницаемости ε.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 712; Нарушение авторских прав?; Мы поможем в написании вашей работы!