
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение I начала ТД к равновесным процессам в идеальных газах
|
|
|
|
Заключение
Была ли у Конта наука следствием его утопии или, наоборот, утопия -следствием его научных воззрений или, наконец, наука и утопия у него были независимы друг от друга? Как бы мы ни ответили на этот вопрос, ясно одно: Конт внес важный вклад в становление социологии как научной дисциплины. Он обосновал ее необходимость и возможность. Это обоснование было по сути своей и неизбежно философским и, шире, мировоззренческим: очевидно, что изнутри социологии обосновать ее было невозможно, так как в качестве самостоятельной науки она еще не существовала. Конт понимал, что он находится лишь у истоков создания новой науки. Он наметил ее программу и отчасти пытался ее реализовать. Кое-что из этих попыток соответствовало его программе, кое-что ей противоречило.
Конт внес серьезный вклад в формирование онтологических парадигм социологического знания, т. е. ключевых представлений о социальной реальности. Он доказывал ставший парадигмальным тезис о том, что социальная реальность - часть всеобщей системы мироздания. Он обосновал идею автономии «социального существования» по отношению к индивидуальному. Он одним из первых разрабатывал такие парадигмаль-ные понятия, как «социальный организм» и «социальная система». (Правда, он еще не различает общество и человечество, считая, что это одни и те же сущности, развивающиеся одинаковым образом). Конт сформулировал эволюционистскую парадигму, доказывая, что все общества в своем развитии раньше или позже проходят одни и те же стадии. Он обосновал разделение обществ на военный и индустриальный типы, которое впоследствии продолжили и развили другие социологи. Его идеи лежат в основе разнообразных теорий индустриализма и технократии. Он зафиксировал выдвижение на авансцену социальной жизни и рост значения новых социальных категорий: предпринимателей, банкиров, инженеров, рабочего класса, ученых. Он был родоначальником одной из главных социологических традиций - традиции исследования социальной солидарности (обозначаемой также терминами «согласие» и «сплоченность»).
|
|
|
В эпистемологическом аспекте огромное значение имел тезис Конта о том, что структура и развитие общества подчинены действию законов, которые необходимо изучать и на основе которых следует строить социальную практику. Его различение социальной статики и социальной динамики в той или иной форме сохранилось на протяжении всей истории социологии, а также проникло в смежные науки. Сохраняют свое значение и многие из его постулатов, касающиеся методов социологии: наблюдения, эксперимента, сравнительно-исторического метода и т. п. Даже его мистический «субъективный» метод оказал известное влияние на судьбы социологической мысли.
В этическом аспекте важную роль в развитии социологии сыграло обоснование Контом выдающейся роли ученого в современном обществе. Его вклад в профессиональную этику новой науки состоял прежде всего в доказательстве необходимости преобладания наблюдения над воображением и в громком призыве не «проклинать» и не «хвалить» социальные факты, а изучать их; тем самым он актуализировал применительно к социологии важнейший для научной этики тезис Спинозы: «Не смеяться, не плакать, а понимать». Правда, сам Конт в своей «субъективной» социологии и «позитивной политике» часто следовал противоположным принципам. Но он с такой силой обосновывал этику непредвзятого, свободного от всяких догм, беспредпосылочного исследования, что позитивизм в социологии всегда связывался именно с такой этикой. Именно она и стала главной для профессии социолога.
|
|
|
Что касается значения Конта для институционально-организационной стороны развития социологии, то здесь можно говорить не о прямом, а лишь о косвенном его влиянии. Время институционализации социологии при нем еще не наступило. Как говорил сам Конт, «колыбель не может быть троном». В его время социология находилась еще в колыбели. Нельзя сказать, чтобы социология когда-нибудь или где-нибудь до сих пор находилась «на троне». Но в том, что она сегодня занимает вполне достойное место среди наук о человеке, заслуга Конта несомненно велика.
Литература
1. Comte A. Catifchisme positiviste. P., 1852.
2. Comte A. Cours de philosophic positive. T. IV. P., 1839.
3. Сен-Симон. Избр. сочинения. М.; Л., 1948. Т. 1.
4. Конт О. Дух позитивной философии (Слово о положительном мышлении). СПб., 1910.
5. Comte A. Discours sur l'esprit positif. P., 1905.
6. Comte A. Cours de philosophie positive. T. V. P., 1841.
7. Comte A. Systeme de politique positive. T. 1. P., 1851.
8. Comte A. Systeme de politique positive. T. IV. P., 1854.
9. Comte A. Systeme de politique positive. Т.П. P., 1852. 10. Comte A. Systeme de politique positive. T. III. P., 1853. И. Маркс К., Энгельс Ф. Соч. 2-е изд. Т. 32.
12. Хайек Ф. Дорога к рабству/ Пер. с англ. Н. Ставиской. Лондон, Нина Карсов, 1983.
Опытным путем, еще до появления молекулярно-кинетической теории, был установлен целый ряд законов, описывающих поведение идеальных газов в различных процессах. Эти законы можно назвать уравнениями процессов. Обобщив эти уравнения, французский физик
Б. Клапейрон вывел уравнение состояния идеального газа, а Д.И. Менделеев ввел универсальную газовую постоянную, поэтому уравнение состояния идеального газа называется уравнением Менделеева-Клапейрона.
Запишем первое начало термодинамики для одного моля идеального газа,  .
.

1) Изохорический процесс - процесс, происходящий при постоянном объеме.
Для изохорического процесса давление и температура связаны между собой законом Гей-Люссака 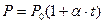 , где
, где  - термический коэффициент изменения давления,
- термический коэффициент изменения давления, 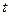 - температура в градусах Цельсия.
- температура в градусах Цельсия.
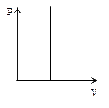
 Это уравнение на диаграмме состояний в
Это уравнение на диаграмме состояний в  -координатах представляет собой прямую параллельную оси
-координатах представляет собой прямую параллельную оси  , а на диаграмме в
, а на диаграмме в 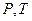 -координатах представляет собой прямую, как бы выходящую из начала координат, если температуру по оси
-координатах представляет собой прямую, как бы выходящую из начала координат, если температуру по оси  , будем откладывать в Кельвинах. Если температуру будем откладывать в Цельсиях, то изохора пересечет ось
, будем откладывать в Кельвинах. Если температуру будем откладывать в Цельсиях, то изохора пересечет ось 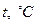 температур в точке
температур в точке  . Отсюда
. Отсюда  .
.
|
|
|
Закон Гей-Люссака имеет и более удобный вид:  .
.
 При изменении состояния идеального газа с
При изменении состояния идеального газа с  на состояние
на состояние  согласно закону Гей-Люссака получим уравнение процесса
согласно закону Гей-Люссака получим уравнение процесса 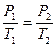 , связывающее параметры начального и конечного состояния идеального газа.
, связывающее параметры начального и конечного состояния идеального газа.
Для этого процесса 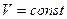 Þ
Þ 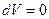 Þ
Þ 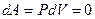 .
.
Система не совершает работу, следовательно, количество теплоты, передаваемое системе, идет на изменение ее внутренней энергии  .
.
Таким образом, I начало ТД для изохорического процесса: количество теплоты, передаваемое системе, идет на изменение внутренней энергии системы. С учетом теплоемкости выглядит так: 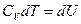 .
.
Изменение внутренней энергии одного моля идеального газа, с учетом молярной теплоемкости и калорического уравнения состояния 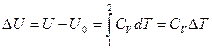 .
.
Для 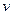 молей вещества
молей вещества 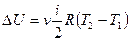 .
.
2) Изобарический процесс - процесс, происходящий при постоянном давлении.
Для изобарического процесса объем и температура связаны между собой законом Гей-Люссака  , где
, где  - термический коэффициент объемного расширения,
- термический коэффициент объемного расширения, 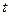 - температура в градусах Цельсия.
- температура в градусах Цельсия.
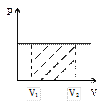 Это уравнение на диаграмме состояний в
Это уравнение на диаграмме состояний в  -координатах представляет собой прямую параллельную оси
-координатах представляет собой прямую параллельную оси  , а на диаграмме в
, а на диаграмме в  -координатах представляет собой прямую, как бы выходящую из начала координат. В общем случае при
-координатах представляет собой прямую, как бы выходящую из начала координат. В общем случае при  закон не выполняется, т.к. газы переходит в жидкое состояние (за исключением гелия). Если температуру будем откладывать в Цельсиях, то изохора как бы пересечет ось
закон не выполняется, т.к. газы переходит в жидкое состояние (за исключением гелия). Если температуру будем откладывать в Цельсиях, то изохора как бы пересечет ось 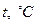 температур в точке
температур в точке  . Аналогично уравнению изохорического процесса, закон Гей-Люссака имеет и другой более удобный вид:
. Аналогично уравнению изохорического процесса, закон Гей-Люссака имеет и другой более удобный вид: 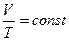 .
.
 При изменении состояния идеального газа с
При изменении состояния идеального газа с  на состояние
на состояние 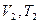 согласно закону Гей-Люссака получим уравнение процесса
согласно закону Гей-Люссака получим уравнение процесса 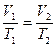 , связывающее параметры начального и конечного состояния идеального газа.
, связывающее параметры начального и конечного состояния идеального газа.
Для этого процесса  Þ
Þ 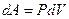 . Система совершает работу при расширении от объема
. Система совершает работу при расширении от объема  до объема
до объема  , температура системы соответственно изменяется от
, температура системы соответственно изменяется от 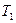 до
до  графически эту работу можно представить, как площадь под графиком процесса в
графически эту работу можно представить, как площадь под графиком процесса в
 -координатах. Вычислим интеграл и получим выражение для работы:
-координатах. Вычислим интеграл и получим выражение для работы:
|
|
|
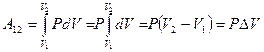 Þ
Þ  .
.
Выразим работу через изменение температуры. Запишем систему из уравнений состояния моля идеального газа и: 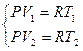 , отнимем от второго уравнения первое
, отнимем от второго уравнения первое
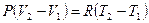 , отсюда получим
, отсюда получим
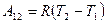 .
.
Для 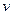 молей вещества:
молей вещества: 
Изменение внутренней энергии в этом процессе  Þ
Þ 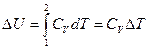 .
.
Для 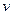 молей вещества
молей вещества 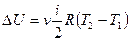 .
.
I начало ТД для изобарического процесса: количество теплоты, передаваемое системе, идет на изменение ее внутренней энергии и совершение системой работы. В дифференциальной форме для одного моля с учетом теплоемкости:
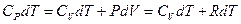 .
.
3) Изотермический процесс - процесс, происходящий при постоянной температуре.
Изотермический процесс можно осуществить, поместив систему, сосуд с поршнем, в термостат. Термостат – тело с настолько большой теплоемкостью  , что его температура при теплообмене с какой-либо системой не меняется. Когда говорят о системе помещенной в термостат, то имеют в виду систему, в которой при всех происходящих в ней процессах (расширение, намагничивание и т.д.) температура поддерживается постоянной.
, что его температура при теплообмене с какой-либо системой не меняется. Когда говорят о системе помещенной в термостат, то имеют в виду систему, в которой при всех происходящих в ней процессах (расширение, намагничивание и т.д.) температура поддерживается постоянной.
Если в этих условиях перемещать поршень вниз, то под действием внешней силы газ будет сжиматься, и работу будет совершать внешняя сила. Если газ будет расширяться, то поршень будет перемещаться вверх, и работу будет совершать газ.
Для реализации условий 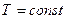 изменения
изменения  должна происходить ¥ - медленно.
должна происходить ¥ - медленно.
 Уравнение изотермического процесса – это уравнение Бойля-Мариотта.
Уравнение изотермического процесса – это уравнение Бойля-Мариотта. 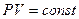
Уравнение изотермы на диаграмме состояний в  -координатах представляет собой гиперболу, положение которой зависит от
-координатах представляет собой гиперболу, положение которой зависит от  . Если газ переходит из состояния
. Если газ переходит из состояния 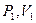 в состояние
в состояние 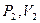 , то уравнение состояния выглядит так
, то уравнение состояния выглядит так  или
или  .
.
Система совершает работу при расширении от объема  до объема
до объема  , давление в системе соответственно изменяется от
, давление в системе соответственно изменяется от 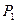 до
до  , графически эту работу можно представить, как площадь под графиком изотермы в
, графически эту работу можно представить, как площадь под графиком изотермы в
 -координатах. Вычислим интеграл и получим выражение для работы одного моля газа:
-координатах. Вычислим интеграл и получим выражение для работы одного моля газа:
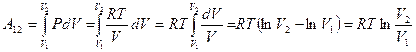 Þ
Þ 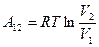 .
.
При вычислении учли, что давление и объем связаны уравнением состояния  , если учтем уравнение процесса, то получим другое выражение
, если учтем уравнение процесса, то получим другое выражение 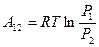 .
.
Для 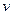 молей идеального газа
молей идеального газа 
Для изотермического процесса 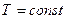 Þ
Þ  Þ
Þ  изменение внутренней энергии равно нулю.
изменение внутренней энергии равно нулю.
I начало ТД для изотермического процесса: в изотермическом процессе все количество теплоты, передаваемое системе, идет на совершение системой работы по расширению. В дифференциальной форме для одного моля: 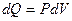 .
.
4) Адиабатический процесс - процесс, происходящий в изолированной системе, когда нет теплообмена с окружающей средой.
Для адиабатического процесса 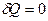 и I начало ТД в дифференциальной форме
и I начало ТД в дифференциальной форме 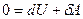 . С учетом зависимости внутренней энергии от температуры:
. С учетом зависимости внутренней энергии от температуры:
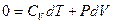
I начало ТД для адиабатического процесса: в адиабатическом процессе система совершает работу за счет убыли внутренней энергии 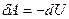 , и наоборот, работа, совершаемая над системой идет на увеличение ее внутренней энергии
, и наоборот, работа, совершаемая над системой идет на увеличение ее внутренней энергии 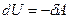 .
.
Получим из I начала ТД и уравнения состояния идеального газа уравнение адиабатического процесса (уравнение адиабаты).
Продифференцируем уравнение состояния для одного моля идеального газа 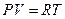 .
.
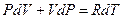 Þ
Þ 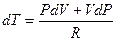 , подставим в I начало ТД
, подставим в I начало ТД
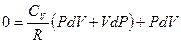 , перегруппируем подобные слагаемые,
, перегруппируем подобные слагаемые,
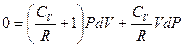 приведем выражение в скобке к общему знаменателю
приведем выражение в скобке к общему знаменателю
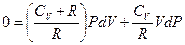 учтем соотношение Майера
учтем соотношение Майера 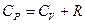 и разделим на
и разделим на 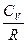
 , введем обозначение отношения
, введем обозначение отношения  , оно называется - показатель адиабаты. Разделим переменные и решим дифференциальное уравнение, взяв интеграл:
, оно называется - показатель адиабаты. Разделим переменные и решим дифференциальное уравнение, взяв интеграл:

 Þ
Þ 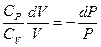 Þ
Þ 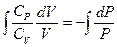 Þ
Þ  отсюда
отсюда
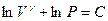 Þ
Þ  Þ
Þ 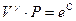 .
.
Уравнение адиабаты  , было получено Пуассоном, и
, было получено Пуассоном, и 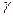 еще называют коэффициентом Пуассона. Учитывая уравнение состояния, для уравнения адиабаты есть и другие способы записи:
еще называют коэффициентом Пуассона. Учитывая уравнение состояния, для уравнения адиабаты есть и другие способы записи:  ,
,  .
.
Уравнения Пуассона применимы только для описания квазистатических адиабатических процессов, уравнения справедливы лишь в интервале давлений, где величина 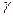 постоянная. Т.к.
постоянная. Т.к.  , то при адиабатическом сжатии газ нагревается, а при адиабатическом расширении – охлаждается.
, то при адиабатическом сжатии газ нагревается, а при адиабатическом расширении – охлаждается.
В общем случае нужно учитывать, что 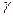 функция
функция 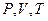 , т.е.
, т.е.  .
.
Уравнение адиабаты на диаграмме состояний в  -координатах представляет собой гиперболу, положение которой зависит от
-координатах представляет собой гиперболу, положение которой зависит от  , но график идет круче чем изотерма для той же системы, т.к. при увеличении объема давление уменьшается быстрее. Если газ переходит из состояния
, но график идет круче чем изотерма для той же системы, т.к. при увеличении объема давление уменьшается быстрее. Если газ переходит из состояния 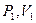 в состояние
в состояние 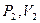 , то площадь под графиком изотермы больше, чем площадь под графиком адиабаты и, следовательно, система изотермическом процессе совершает большую работу, чем в адиабатическом процессе при том же расширении.
, то площадь под графиком изотермы больше, чем площадь под графиком адиабаты и, следовательно, система изотермическом процессе совершает большую работу, чем в адиабатическом процессе при том же расширении.
Вычислим работу, совершаемую идеальным газом в адиабатическом процессе расширения от объема  до объема
до объема  :
:
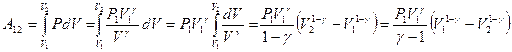 , если вынести из скобок
, если вынести из скобок 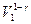 , учесть
, учесть 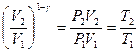 то получим более простые выражения
то получим более простые выражения
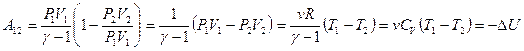 .
.
Каждое выражение можно использовать для вычисления численного значения произведенной работы в конкретном процессе.
Таким образом, работа при одном и том же изменении объема в адиабатическом процессе меньше, чем в изотермическом процессе. Но она существенно зависит от показателя адиабаты 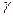 . При значении
. При значении  величина работы стремится к значению при изотермическом процессе.
величина работы стремится к значению при изотермическом процессе.
5) Политропный процесс - процесс, при котором теплоемкость системы остается постоянной  . При таком процессе происходит частичный теплообмен системы с окружающей средой.
. При таком процессе происходит частичный теплообмен системы с окружающей средой.
Это самый общий процесс, т.к. полностью исключить теплообмен системы с окружающей средой практически невозможно.
I начало ТД для политропного процесса: количество теплоты, передаваемое системе, идет на изменение ее внутренней энергии и совершение системой работы. В дифференциальной форме для одного моля с учетом теплоемкости:

Получим из I начала ТД и уравнения состояния идеального газа уравнение политропного процесса (уравнение политропы)
Продифференцируем уравнение состояния для одного моля идеального газа 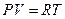 .
.
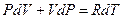 Þ
Þ 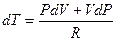 , подставим в I начало ТД
, подставим в I начало ТД

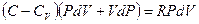 , перегруппируем подобные слагаемые,
, перегруппируем подобные слагаемые,

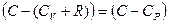 учтем соотношение Майера
учтем соотношение Майера 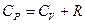
 разделим на
разделим на 
 , введем обозначение отношения
, введем обозначение отношения 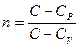 , оно называется - показатель политропы.
, оно называется - показатель политропы.
Разделим переменные и решим дифференциальное уравнение, взяв интеграл:
 Þ
Þ  Þ
Þ 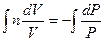 Þ
Þ 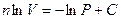 отсюда
отсюда
 Þ
Þ 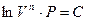 Þ
Þ 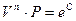 .
.
Уравнение политропы  .
.
Учитывая уравнение состояния, для уравнения политропы, аналогично уравнению адиабаты, есть и другие способы записи:
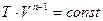 ,
, 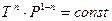 .
.
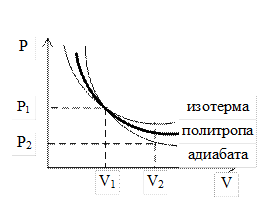
График политропы на диаграмме состояний в  - координатах представляет собой гиперболу, занимающую промежуточное положение между изотермой и адиабатой.
- координатах представляет собой гиперболу, занимающую промежуточное положение между изотермой и адиабатой.
Работа, совершаемая в политропном процессе, вычисляется аналогично работе в изобарическом процессе:
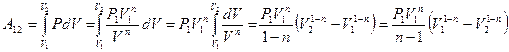
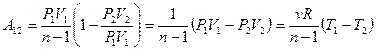 .
.
Если 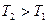 , то
, то 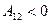 работа совершается над газом, газ сжимается.
работа совершается над газом, газ сжимается.
Изменение внутренней энергии в этом процессе  Þ
Þ 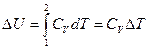 , как и для всех других процессов в идеальном газе.
, как и для всех других процессов в идеальном газе.
Для 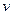 молей вещества
молей вещества 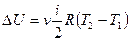 .
.
Числовые значения показателя политропы 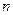 определяются опытным путем.
определяются опытным путем.
 Зависимость теплоемкости
Зависимость теплоемкости 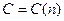 от
от 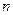 для идеального газа показана на графике.
для идеального газа показана на графике.
Все изопроцессы могут быть рассмотрены, как предельные случаи политропного процесса.
1) адиабатический процесс  .
.
В этом процессе 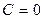 , показатель политропы превращается в показатель адиабаты
, показатель политропы превращается в показатель адиабаты 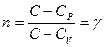 .
.
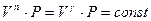 уравнение политропы превращается в уравнение адиабаты.
уравнение политропы превращается в уравнение адиабаты.
 ,
, 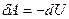 ,
, 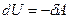 .
.
2) изотермический процесс 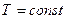 .
.
В этом процессе 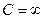 , показатель политропы равен единице
, показатель политропы равен единице  .
.
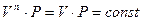 уравнение политропы превращается в уравнение изотермы.
уравнение политропы превращается в уравнение изотермы.
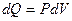 ,
, 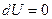 ,
, 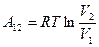 .
.
3) изобарический процесс  .
.
В этом процессе 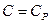 , показатель политропы равен нулю
, показатель политропы равен нулю  .
.
 , уравнение политропы превращается в уравнение изобары.
, уравнение политропы превращается в уравнение изобары.
 ,
,  ,
,  ,
,  .
.
4) изохорический процесс 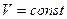 .
.
В этом процессе  , показатель политропы равен бесконечности
, показатель политропы равен бесконечности 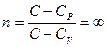 .
.
 , уравнение политропы превращается в уравнение изохоры.
, уравнение политропы превращается в уравнение изохоры.
 ,
,  ,
,  .
.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 569; Нарушение авторских прав?; Мы поможем в написании вашей работы!