
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи одержання одноосновних карбонових кислот
|
|
|
|
1. Окислення вуглеводнів.
Дивись тему "Окислення парафінів", а також тему "Окислення ароматичних вуглеводнів".

Жорсткі умови: хромова суміш, та KMnO4 при звичайних т-рах та окислюють насичені вуглеводні.
2. Окиснення первинних спиртів та альдегідів
Метод є універсальним. Окиснення спиртів обов'язково йде через стадію утворення альдегідів, які в залежності від умов можуть бути виділені або окиснюються далі відразу. Може застосовуватися одночасно і дегідрування спиртів.
Промисловий метод отримання оцтової кислоти:

1. Окислення кетонів
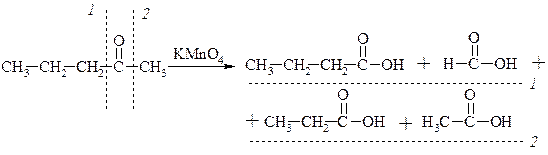
3. З галегенопохідних через реактиви Гриньяра
Метод є універсальним

4. Виходячи з нітрилів (ціанопохідгих вуглеводнів)
Метод є універсольним. У аліфатичному ряду нітрили отримують із галогенопохідних, у аліфатичному – через солі діазонія (дивись раніше)
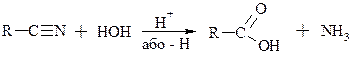
R=Alk, Ar
Але ще досить багато специфічних, але важливих методів, наприклад:
а) м-д оксосинтезу

б)

гліцеріди к-ти (природні жири це складні ефіри гліцерину та пальмітінової C15H31COOH (R=C15H31) чи олеїнової к-ти C17H33COOH (R=C17H33)
вищі жирні аліфатичні кислоти)
в)

Це один з варіантів оксосинтезу.
5. Синтез за допомогою малонового естеру. Алкілування малонового естеру за метальною групою галогеналканом і наступне декарбоксилування дозволяє одержати кислоти певної будови:

6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
Наприклад:
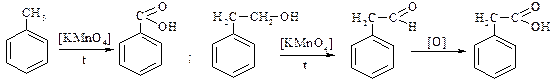
7. Гідроліз галогенопохідних

Будова карбоксильної групи
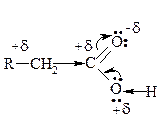
| Карбоксил не є простим механічним сполученням карбонільної та гідроксильної групи. |
За рахунок взаємного впливу карбоніла та гідроксила їх характер змінюється в порівнянні з альдегідами, з одного боку, та спиртами з другого боку.
|
|
|
а) Карбоніл непридатний до реакції нуклеофільного приєднання. Неможливі реакції полімерізації і т.д. Тобто подвійний зв'язок С=О стає пасивним, за рахунок додаткового "стягування" вільної електронної пари з сусіднього атома кисня гідроксильної групи;
б) Це призводить до значного послаблення зв'язоку О-Н та гідроксил різко підвищує свою кислотність з одного боку, і набагато зменшує свою рухливість (зростає міцність зв'язоку С-О).
Хімічні властивості карбонових кислот
1. Кислотні властивості

| 
|
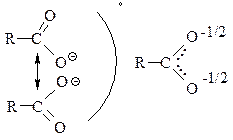
| Якщо R-донор, кислотні властивості зменшуються, якщо R-акцептор вони збільшуються. |
Далі прокоментувати цифрові дані:
| pKa | Ka | Карбонові кислоти дають солі титруються кількісно лугами | |
| 3,75 | 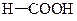
| 1,77×10-4 | |
| 4,76 | 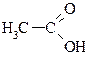
| 1,76×10-5 | |
| 4,89 | 
| 1,34×10-5 | |
| 4,17 | 
| 6,27×10-5 | Кислотні властивості збільшуються у порівнянні з оцтовою кислотою за рахунок підвищеної стабільності виникаючого супряженого карбоксилат-аніону. |
| 4,26 | 
| 5,6×10-5 | |
| ~×0,6 | 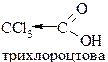
| 2,0×10-1 | Дають солі:
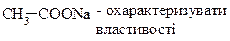

|
Вплив замісників у ядрі ароматичних кислот на їх силу.

Природа замісника Х, як і його положення будуть впливати на силу кислоти, це показано:
| кислота | 
| рКа |
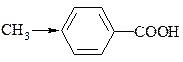
| lgKax-4,38 | 4,38 |

| lgKax-4,21? | 4,17 |
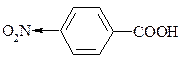
| lgKax-3,43 | 3,43 |
а) Декарбоксилювання кислот.
Ця реакція характерна для будь-яких кислот і приводить до заміщення карбоксила на водень. Легкість декарбоксилювання зростає зі зростанням сили кислоти.

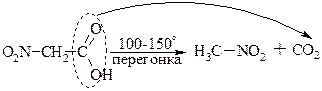
Декарбоксилювання може бути здійснено електрохімічним шляхом (див.тему "Алкани" електр.хім.синтез Кольбе)
б) Відновлення кислот
Самі кислоти (аліфатичні і ароматичні) відновлюються досить важко. Але під дією к-ра LiAlH4 досить просто відновлюються до відповідних спиртів.

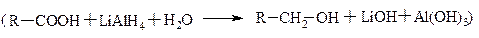
Похідні кислоти відновлюються значно легше.

в) Реакції з участю вуглеводневих радикалів
Аліфатичний ряд:
|
|
|
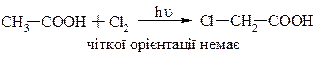
В присутності Н+ (електрофільне заміщення в основному у a-положення).
Радикальне заміщення йде досить безпорядково.
Ароматичні кислоти:

Окрім вище розглянутих реакцій, для кислот, характерні числені інші реакції, зв'язані з перетворенням карбоксильної групи.
Важливе значення в органічному синтезі мають функціональні похідні карбонових кислот: аміди, ангідриди, галогенангідриди, нітрили, естери.
Схеми реакцій утворення функціональних похідних:

Галогенгідриди – дуже реакційно здібні сполуки. Це прекрасні ацилюючі агенти (дати визначення реакцій ацилювання)
Залишок кислоти без групи ─ОН (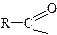 ) називається ацилом. Реакцію введення цієї групи в молекули інших сполук називають ацилюванням. Розрізняють С-, О- і N-ацилювання:
) називається ацилом. Реакцію введення цієї групи в молекули інших сполук називають ацилюванням. Розрізняють С-, О- і N-ацилювання:
1) Ацилювання за зв’язком С-Н (С- ацилювання):

2) Ацилювання за зв’язком О-Н (О- ацилювання):
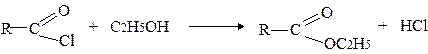
3) Ацилювання за зв’язком N-Н (N- ацилювання):


| 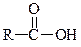
| |

| Амід кислоти | |
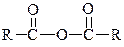
| Ангідрид кислоти | |

| Складний ефір | |
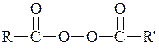
| Пероксид ацилу |
Ці реакції являють собою нуклеофільне заміщення галогену і можуть протікати за слідуючим механізмом (найчастіше):

Як зображенно на схемі реакція проходить за механізмом приєднання відщеплення – механізм А-Е.
Чим вищім є позитивних заряд на вуглецевому атомі карбоксилу, тим активнішим є галогенагідрид.
Ряд ацилюючих агентів:
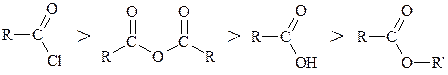
Деякі властивості похідних кислот
Аміди на відміну від амінів не мають основних властивостей. Більш того водень біля атому азоту є навіть в певній мірі "кислим".
При дегідратації дають нітрили:

Аміди можуть бути отримані через кислоти:

Ангідриди кислот – можуть бути отримані дегідратацією кислот:

Це рідини які не розчиняються у воді. Є добрими ацилюючими агентами.

Ненасичені кислоти
Найпростіші ненасичені одноосновні кислоти:

Ненасичені кислоти можуть існувати у вигляді двох геометричних ізомерів – цис-транс:
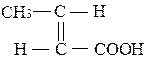

транс-ізомер (кротонова кислота) цис-ізомер (ізокротонова кислота)
(tпл. = 720С, tкип. = 1890С) (tпл. = 15,50С, tкип. = 1720С)
Найчастіше одноосновні кислоти мають вищі кислотні властивості, ніж відповідні насичені. Пояснюється це взаємним впливом (спряженням) карбоксильної групи та подвійного зв’язку. Вплив подвійного зв’язку на кислотність зменшується по мірі віддалення подвійного зв’язку від карбоксильної групи. Тому вінілоцтова кислота сильніша за аллілоцтову.
|
|
|
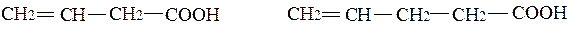
Ка = 4,6·10 -5 Ка = 2,1·10 -5
Характерною особливістю ненасичених кислот та їх ефектів є полімеризація з утворенням полімерів (органічного скла) з цінними технологічними властивостями. Такі полімери мають ланцюгову структуру:

метиловий ефір метакрилової кислоти
(метилметакрилат)
Важливе похідне акрилової кислоти її нітрил (акрилонітрил), який застосовується в реакціях полімеризації та співполімеризації при синтезі, наприклад, бутадієн-нітрильного каучуку.
Ненасичені двохосновні кислоти – малеїнові та фумарова теж існують як два структурні ізомери:
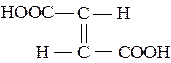
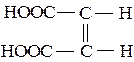
транс-ізомер (фумарова кислота) цис-ізомер (малеїнова кислота)
(tпл. = 2880С) (tпл. = 1300С)
Обидві кислоти дають характерні реакції на подвійний зв’язок (знбарвлюють бромну воду, перманганат калію), а також реакції за карбоксильної групою (моно - або - дипохідні).
Особливість малеїнової кислоти – утворення циклічного ангідриду:

малеїнова кислота малеїновий ангідрид
ДВОХОСНОВНІ КАРБОНОВІ КИСЛОТИ
| Назва | Формула | Т пл. |
| Щавлева | HOOC-COOH | 189,5 |
| Малонова | HOOC-CH2-COOH | 135,6 |
| Бурштинова | HOOC-(CH2)2-COOH | |
| Глутарова | HOOC-(CH2)3-COOH | 97,5 |
| Адіпінова | HOOC-(CH2)4-COOH | |
| Фталева (о) | C6H4(COOH)2 | |
| Ізофталева (м) | C6H4(COOH)2 | |
| Трефталева (н) | C6H4(COOH)2 | > 350 |
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3187; Нарушение авторских прав?; Мы поможем в написании вашей работы!