
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Специфіка філософського знання. 8 страница
|
|
|
|
CP = CV + R, де R − універсальна газова стала.
Безпосередні вимірювання CP і CV здійснити важко, оскільки теп- лоємність газу є малою часткою теплоємності посудини, що містить
С
газ. Легше виміряти відношення величин γ =
р, яке називають ко-
 С
С
ефіцієнтом Пуассона. Виходячи з уявлень класичної молекулярно- кінетичної теорії, можна показати, що для ідеального газу
 γ = C P = i + 2,
γ = C P = i + 2,
CV i
де i - число ступенів свободи молекули.
Коефіцієнт Пуассона γ входить до рівняння Пуассона:
 PVγ = const,
PVγ = const,
яке описує зв'язок між тиском P і об'ємом V ідеального газу при адіа- батичному процесі.
Метод Клемана - Дезорма для визначення відношення теплоємно-
K p
P1
P2
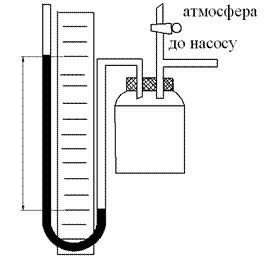 h
h
A Pатм
1 (P1, V1, T1)
адіабатичне розширення
3 (P2, V2, T1)
2 (Pатм, V2, T2)
V1 V2
Pис.1
Pис.2
стей газів
|
 γ = С
γ = С
 v
v
базується на використанні методу адіабатичного
розширення. Адіабатичним називається процес, який відбувається без
теплообміну системи з навколишнім середовищем. Адіабатичний процес можна здійснити або за допомогою теплової ізоляції системи,
або за умову короткочасності процесу (за малий проміжок часу не встигає відбутись тепловий обмін з навколишнім середовищем).
У скляний балон A (рис.1) за допомогою насоса накачують пові- тря. При швидкому накачуванні температура останнього дещо підви-
щується, а тому потрібно зачекати 2−3 хв для встановлення в балоні тієї ж самої температури, що і в навколишньому середовищі. Цей стан
газу будемо вважати початковим і характеризувати параметрами V1,
T1, P1.
На рис.2 даний стан зображено точкою 1. При цьому
P1 = Pатм + h1,
де Pатм − атмосферний тиск, h1 − надлишок тиску над атмосферним. Далі відкривають кран К балона на дуже короткий проміжок часу і
|
|
|
перекривають його у той момент, коли тиск всередині балона дорів- нюватиме атмосферному. При цьому газ перейде в новий стан з пара- метрами V2, T2, Pатм (на рис.2 даний стан зображено точкою 2).
Оскільки розширення повітря відбувається швидко, то можна
вважати, що процес переходу газу із стану 1 у стан 2 адіабатичний. Тому для нього можна застосувати рівняння Пуассона:
1 1 =
2; (
+ 1) 1 =
2. (1)
P V γ
PатмV γ
Pатм
h V γ
PатмV γ
Підкреслимо, що T2<T1 оскільки при адіабатичному розширенні
газ охолоджується. Через 2−3 хв газ нагріється до температури навко- лишнього повітря Т1. При нагріванні об'єм V2 залишається без змін, а тиск підвищується до значення
P2 = Pатм + h2,
де h2 − надлишок тиску над атмосферним після адіабатичного розши-
рення та ізохоричного нагрівання до температури T1.
Параметри нового стану 3 позначимо через V2, Р2, Т1, (на рис.2
− точка 3). Істотно, що в станах 1 і 3 газ має однакову температуру,
отже, стани 1 і 3 знаходяться на одній ізотермі. Тому до них можна застосувати закон Бойля-Маріотта:
P1V 1 = P2V 2
; (Pатм+ h1)V1 = (Pатм+ h2)V2
. (2)
Після ряду перетворень з рівнянь (1) і (2) отримаємо:
γ = h1.
h1 − h2
Порядок виконання роботи
1. Накачують у балон A повітря, не виходячи за поділки шкали манометра.
2. Зачекавши 2−3 хв, доки температура в балоні не стане дорівню- вати температурі навколишнього повітря, відраховують покази мано-
метра h1.
3. Відкривши на короткий час кран К, вирівнюють тиск всередині балона з атмосферним. Коли стовпчики рідини в манометрі зрівня-
ються, кран закривають.
4. Чекають 2−3 хв, відраховують покази манометра h2.
 5. Для кожного досліду розраховують γ за формулою (3). Повто- рюють дослід не менше 5 разів.
5. Для кожного досліду розраховують γ за формулою (3). Повто- рюють дослід не менше 5 разів.
6. Результати вимірювань заносять у таблицю.
7. Визначають відносну похибку результатів вимірювань:
|
|
|
|
|
|
∆ + ∆

|
|
|
1 h2
,
h1 − h2
де ∆ h1 = ∆h2 = 2с, де c − ціна поділки шкали манометра.
|
|
|
γ γ

 9. Порівнюють одержаний результат з теоретичним значенням γ пові- тря.
9. Порівнюють одержаний результат з теоретичним значенням γ пові- тря.
| № п/п | Результати прямих вимірювань | Результати непрямих вимірювань | |
| h1 | h2 | γ | |
| с | − |
Запитання для самоконтролю
1. Запишіть і сформулюйте основне рівняння молекулярно- кінетичної теорії газів.
2. Дайте визначення числа ступенів свободи тіла (системи, мо- лекули) і виразіть молярні теплоємності ідеального газу через кіль- кість ступенів свободи молекули.
3. Дайте визначення та отримайте вираз для внутрішньої енергії ідеального газу.
4. Запишіть і сформулюйте перший закон термодинаміки, засто- суйте його до різних ізопроцесів у газах.
5. Запишіть співвідношення Майєра і поясніть фізичний зміст універсальної газової сталої.
6. Який процес називається адіабатичним? Як і чому змінюється температура газу при адіабатичній зміні його об'єму?
7. Запишіть рівняння Пуассона і поясніть зміст коефіцієнта Пуа- ссона. Зобразіть графік адіабати.
РОБОТА 2.3
ВИЗНАЧЕННЯ КОЕФІЦІЄНТА ПОВЕРХНЕВОГО НАТЯГУ РІДИНИ МЕТОДОМ ВІДРИВУ КРАПЕЛЬ
Мета роботи: вивчити явище поверхневого натягу; визначити коефіцієнт поверхневого натягу рідини.
Прилади та обладнання: скляна бюретка з краном, склянки з рідинами.
Поверхневі властивості рідини обумовлені особливостями взає- модії молекул у поверхневому шарі. Товщина цього шару дорівнює декільком молекулярним відстаням, тобто приблизно 10-9м.
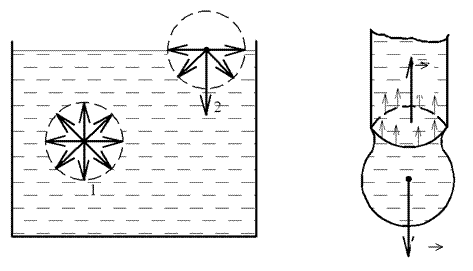
Поки молекула знаходиться у глибині рідини, вона рівномірно оточена іншими молекулами, які в середньому притягують її у всі
сторони з однаковими силами. Рівнодійна цих сил дорівнює нулю (рис.1, молекула 1). Рівнодійна ж сил притягання, які діють на моле- кули поверхневого шару, не дорівнює нулю (оскільки над поверхнею рідини знаходиться газ, густина якого в багато разів менша, ніж гус- тина рідини) і направлена всередину рідини (див. рис.1, молекула 2). Перехід молекули з глибини рідини в поверхневий шар супроводжу- ється роботою проти сил молекулярного притягання. Тому молекули
|
|
|
поверхневого шару мають додаткову потенціальну енергію порівняно з молекулами в решті об'єму. Намагаючись зменшити енергію, повер- хня скорочується. Поверхневий шар рідини знаходиться в напруже-
ному стані, схожому на розтягнуту плівку, яка прагне скоротитися. У поверхневому шарі діють сили поверхневого натягу F, які направлені по дотичній до поверхні перпендикулярно до будь-якого елемента лі- нії на поверхні рідини і які пропорційні довжині контуру l:
 F = σl
F = σl
, (1)
де σ − коефіцієнт поверхневого натягу.
З формули (1) випливає, що σ чисельно дорівнює силі поверхне-
вого натягу, яка припадає на одиницю довжини лінії на поверхні ріди-
ни і вимірюється в Н/м.
У даній роботі використовується один із методів визначення кое- фіцієнта поверхневого натягу рідини − метод відриву крапель. Із
скляної бюретки капає рідина. Поки крапля мала, вона не відриваєть- ся. Її утримують сили поверхневого натягу. Краплина відривається в
той момент, коли сила тяжіння краплі mg
буде дорівнювати рівно-
дійній сил поверхневого натягу F, що діють уздовж кола шийки кра- плі (див. рис. 2):
F = mg. (2)
 F
F
mg
Pис.1 Pис.2
Сила поверхневого натягу визначається з виразу:
F =σπd
, (3)
де l = πd
− периметр шийки краплини в момент її відриву. Отже, в
момент відриву краплини
mg =σπd.
Звідси знаходимо σ:
mg
 σ =. (5)
σ =. (5)
πd
Коефіцієнт σ2 досліджуваної рідини визначаємо, порівнюючи його з відомим σ1 другої рідини.
Нехай визначений об'єм рідини V містить n1 крапель однієї рі- дини (еталонної) і n2 крапель другої (досліджуваної). При цьому сили тяжіння однієї краплі відповідно дорівнюють:
m1 g
 = ρ 1Vg n1
= ρ 1Vg n1
і m2 g
 = ρ 2Vg, (6)
= ρ 2Vg, (6)
n2
де ρ1, ρ 2 − густини відповідних рідин. Тому
σ 1 =
 m1 g
m1 g
πd
 = ρ1Vg
= ρ1Vg
πdn1
|
|
|
i σ2 =
 m2 g
m2 g
πd
 = ρ2Vg
= ρ2Vg
πdn2
. (7)
З формули (7) маємо:
n1 ρ2
n2 ρ1
. (8)
Отже, якщо відомий коефіцієнт поверхневого натягу якоїсь кон- кретної рідини, то цим методом можна визначити коефіцієнт поверх- невого натягу будь-якої іншої рідини.
Порядок виконання роботи
1. Наповнюють бюретку дистильованою водою.
2. Обережно відкривають кран, щоб краплі капали рівномірно. Відраховують n1 − кількість крапель з об’єму 2 мл. Дослід повторюють декілька разів.
3. Те ж саме роблять з іншою рідиною. Відраховують n2 − кількість крапель з такого ж самого об'єму (2 мл).
4. За таблицями знаходять ρ1, ρ 2, σ 1.
5. За робочою формулою (8), використовуючи середні значення,
‹ n1 ›, ‹ n2 › розраховують ‹ σ2 ›. Дані заносять у таблицю.
|
|
і довірчу границю сумарних
|
за формулами:
ε ε ε ε
σ 2 σ 1 1 2
ε ρ1
ε ρ2 ∆ 2 σ ε 2
|
= 〈 〉.
|
Запитання для самоконтролю
1. Вкажіть причини молекулярного тиску в рідинах.
2. Чим обумовлений поверхневий натяг?
3. Дайте визначення коефіцієнта поверхневого натягу. В яких одиницях він вимірюється?
4. Опишіть явища на границі рідини з твердим тілом. Що нази- вається крайовим кутом змочування?
5. Запишіть формулу Лапласа і поясніть її.
6. Що таке капілярні явища? Наведіть доведення формули для висоти підняття рідини у капілярі.
7. Як використовують капілярні явища в процесах обробки ґру-
нту?
РОБОТА 2.4
ВИЗНАЧЕННЯ ЗМІНИ ЕНТРОПІЇ ПРИ НАГРІВАННІ І ПЛАВЛЕННІ ОЛОВА
Мета роботи: визначити приріст ентропії олова при його нагрі- ванні і плавленні.
Прилади та обладнання: тигель з оловом, електроплитка, термопара, градуйований графік термопари, мікровольтметр,
секундомір, склянка з водою.
За визначенням, ентропія S − це функція стану системи, дифе- ренціал якої дорівнює елементарній приведеній теплоті:
 dS = δQ, (1)
dS = δQ, (1)
T
де δQ
− означає нескінченно малу кількість теплоти, яку отримала
система при оборотному теплообміні з резервуаром, що має темпера- туру T. Термодинамічна температура T, яка вимірюється в кельвінах, пов’язана з температурою t за шкалою Цельсія таким співвідношен- ням:
T = t +273,15. (2) Для практичних цілей потрібно знати не саму величину ентропії
S, а лише її зміну ∆S. Якщо ентропію в стані 1 позначити S1, а в стані
2 − S2, то зміна ентропії при оборотному переході системи із стану 1
до стану 2 дорівнює:
|
 ∆S = S1 − S2 = ∫
∆S = S1 − S2 = ∫
1 T
. (3)
При зміні температури від Т до T + dT однорідне тіло одержує елементарну кількість теплоти
δQ=cmdT
, (4)
де c − питома теплоємність; m − маса тіла.
При нагріванні тіла від температури T1 до T2 згідно з (3) і (4)
зміна ентропії становить:
S = cm
T2 dT
= cmln T2
. (5)

|
У випадку ізотермічного (Т = const) переходу із стану 1 до ста- ну 2 співвідношення (3) має вигляд:
Q
 ∆S =
∆S =
T
, (6)
де Q − кількість теплоти, одержаної тілом у процесі 1 → 2.
У даній лабораторній роботі визначається зміна ентропії олова при його нагріванні і плавленні. Якщо спочатку температура олова дорівнює кімнатній, то при підведенні теплоти олово спочатку нагрі- вається до температури плавлення, а потім плавиться при постійній температурі.
Приріст ентропії ∆S1 при нагріванні олова від кімнатної темпе- ратури Tк до температури плавлення Tпл (перший етап процесу нагрі- вання) одержують, приймааючи у виразі (5) T1=Tк і Т2=Тпл;
∆S1
= cmln T пл
Тк
. (7)
Приріст ентропії ∆S2 у результаті плавлення олова при температурі
Tпл (другий етап процесу) визначають з виразу (6), приймаючи Т2=Тпл
і Q = λm
, де λ − питома теплота плавлення:
∆S 2 =
Повна зміна ентропії дорівнює:
 λm
λm
T пл
. (8)
∆S = ∆S1
+ ∆S 2
= cmln T пл
Т к
 λm
λm
+
T пл
(9)
Для обчислення ∆S потрібно знати параметри, що входять в (9), зокрема необхідно виміряти температуру плавлення олова.
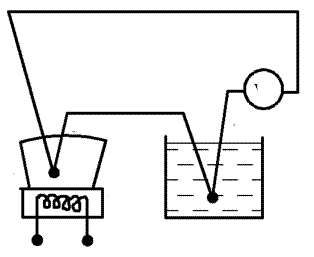
Схему установки зображено на рис.1. Тигель (1) з оловом нагрі- вається на електроплитці (2). Для вимірювання температури олова ви- користовують термопару. Один із спаїв (3) термопари занурений у ти-
гель з оловом, другий (4) - у склянку з водою. За наявності різниці те- мператур спаїв у колі термопари виникає термоелектрорушійна сила
(т.е.р.с.), яку вимірюють мікровольтметром V. Залежність т.е.р.с. від різниці температур спаїв близька до лінійної, її зображено на градуйо-
ваному графіку термопари. Графік додається до установки і викорис-
товується для визначення температури плавлення олова.
Порядок виконання роботи
1. Заносять у табл. 1 значення табличних величин для олова:
с = 230
 Дж;
Дж;
кг ⋅К

|
маса олова в досліді m = 0,100 кг.
2. За допомогою термометра визначають кімнатну температуру
tк і розраховують температуру Tк за формулою (2).
3. Вмикають електроплитку і стежать за показами вольтметра V.
Починаючи з напруги V ≈ 4мВ
, записують у табл. 2 у графу "Нагрі-
вання" покази мікровольтметра через кожну хвилину.
Спочатку значення V збільшуватимуться − підвищується темпе- ратура твердого олова. Потім настане момент, коли покази вольтметра
практично не змінюватимуться (V=const=Vпл) − процес плавлення олова відбувається при сталій температурі Тпл = const. Після того, як все олово розплавиться, починається швидке зростання значень V (це нагрівається розплав). Вимірювання припиняють, записавши декілька даних для третьої ділянки кривої. Нагрівання в цілому продовжується приблизно 20 хв.
4. Вимикають електроплитку і, дочекавшись, коли покази вольт- метра почнуть зменшуватись, записують їх у табл. 2 у графу "Охоло-
"Охолодження" з інтервалом в одну хвилину. Час відраховують від умовного нуля.
5. За даними табл. 2 будують графік залежності показів вольт-
метра V від часу τ для нагрівання та охолодження.
6. За графіками визначають середнє значення Vпл, яке відпові- дає ділянкам кривих, паралельних осі абсцис τ.
7. Використовуючи градуйований графік, за значенням Vпл зна-
ходять температуру:
∆t = tпл − tв,
де tпл − температура гарячого спаю, що дорівнює температурі плавлення олова; tв − температура холодного спаю, що дорівнює тем- пературі води у склянці; tв вимірюють термометром, а tпл розрахову- ють за формулою tпл= tв+ ∆ t. Тпл обчислюють за формулою (2). Усі дані заносять до табл. 1.
8. За формулою (9) розраховують ∆ S.
Таблиця 1
| № п/п | Табличні величини | Результати прямих вимірю- вань | Результати непрямих вимірювань | ||||||||
| C, Дж/кгК | λ, Дж/кг | m, кг | tк, 0С | tв, 0С | Тк, К | Vпл, мВ | ∆ t, 0С | tпл, 0С | Тпл, К | ∆S, Дж/К | |
|
V
 3 4
3 4
Pис.1
Запитання для самоконтролю
1. Які процеси називають оборотними, необоротними? Наведіть приклади.
2. Що таке приведена теплота?
3. Дайте визначення ентропії, укажіть одиницю її вимірювання.
4. Який фізичний зміст ентропії?
5. Сформулюйте принцип зростання ентропії.
6. Наведіть різні формулювання другого закону термодинаміки.
7. Дайте виведення робочої формули.
РОБОТА 2.5
ВИЗНАЧЕННЯ ВОЛОГОСТІ ПОВІТРЯ
Мета роботи: визначити абсолютну і відносну вологість повітря психрометром Августа.
Прилади та обладнання: психрометр Августа, таблиця тиску на- сиченої водяної пари при різних температурах.
Атмосферне повітря − це суміш різних газів і водяної пари. Кіль- кість цих парів може змінюватись як за абсолютною величиною, так і за ступенем насиченості, що характеризується абсолютною та віднос- ною вологістю.
Абсолютна вологість повітря − це маса водяної пари, що міститься в 1м3 повітря при даних умовах. У системі СІ абсолютна вологість ви- мірюється в кг/м3. Абсолютну вологість вимірюють ще парціальним тиском водяної пари P (пружність пари). Тиск, який чинила б водяна пара, якби всіх інших газів не було, називають парціальним тиском водяної пари, його виражають в одиницях тиску − паскалях, або в мі- ліметрах ртутного стовпчика.
Відносною вологістю повітря r називають виражене у відсотках відношення парціального тиску P водяної пари, що міститься в повіт-
рі при даній температурі (абсолютна вологість), до тиску P насиченої водяної пари при тій самій температурі:
r= P
P
100%
. (1)
Вологість повітря вимірюють спеціальними приладами. В даній роботі для визначення вологості використовується психрометр Авгус- та. Цей прилад складається з двох однакових термометрів. Резервуар
одного з них сухий і термометр показує температуру повітря. Резерву- ар другого обгорнутий смужкою тканини (батист), кінець якої знахо- диться у воді. Вода випаровується, а термометр охолоджується. Чим менша відносна вологість, тим інтенсивніше випаровується вода і тим нижчу температуру показує термометр. Відліки по двох термометрах дадуть різницю температур, яка і буде характеризувати вологість по- вітря.
Метод психрометра
Розглянемо сталий режим випаровування, коли температура "во-
логого" термометра теж стала. Приплив теплоти Q1 ззовні дорівнює витраті теплоти Q2. Кількість теплоти, отриманої за одиницю часу, визначається за виразом:
Q1 =α
(t−t1)S1,
де t − температура сухого термометра; t1 − температура "вологого" термометра; S1 − площа поверхні балона "вологого" термометра; α − коефіцієнт пропорційності. Маса m води, що випаровується за одини-
цю часу, визначається за формулою:
|
Pa
де S2 − площа поверхні, з якої йде випаровування; Pa − атмосферний
|
−парціальний тиск насиченої водяної пари при температурі t1
 ; P − парціальний тиск водяної пари, що міститься у повітрі; c − кое- фіцієнт пропорційності, який залежить від швидкості потоку повітря. Кількість теплоти Q2 можна записати у вигляді:
; P − парціальний тиск водяної пари, що міститься у повітрі; c − кое- фіцієнт пропорційності, який залежить від швидкості потоку повітря. Кількість теплоти Q2 можна записати у вигляді:
cLS 2 (P1 −P)
Q2 =,
 P a
P a
де L − питома теплота випаровування води.
ПриQ1=Q2 іS1=S2 маємо:
|
|
Pa
Звідси знаходимо абсолютну вологість:
 P= P1 – A(t-t1) Pa, (2)
P= P1 – A(t-t1) Pa, (2)
де А = α/cL− постійна приладу.
Порядок виконання роботи
1. Змочують батист, яким обгорнута кулька термометра,
занурюючи кінець його в чашку з водою.
2. Проводять відлік температури по "сухому" термометру t і
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 378; Нарушение авторских прав?; Мы поможем в написании вашей работы!