
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Логарифм константы скорости прямолинейно зависит от обратной температуры процесса
|
|
|
|
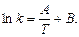 (35)
(35)
Постоянные уравнения (35) определяются графически:

 lnk
lnk
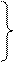


 ln k2
ln k2  ;
;
 ∆x
∆x

 ln kx α 1)
ln kx α 1)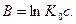

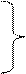 x 2)
x 2)
Из анализа уравнения (35) следует,
В=lnK0 что правила Аррениуса фактически
 0 представляет собой неопределенный
0 представляет собой неопределенный
1/T1 1/Tx 1/T интеграл изобары Вант-Гоффа:
 . (36)
. (36)
Где Кр – константа равновесия равная 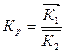
 определяемая как отношение константы скоростей прямой и обратной реакции из I - закона ЗДМ.
определяемая как отношение константы скоростей прямой и обратной реакции из I - закона ЗДМ.
∆Н - изменения энтальпии (тепловой эффект) процесса химического взаимодействия.
Тогда уравнение (36) можно вид как:
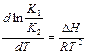 или
или
как два уравнения:
 и
и  (36)
(36)
где Е1 и Е2 − энергия активаций прямой и обратной реакций.
Если взять определенный интеграл из уравнений (36∕) при двух температурах, получим:
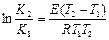 (37)
(37)
Из которого можно определить, если будут известны:
Ех (Т1, Т2, К1, К2), где Ех/ап = 
Тх (Е, К1, К2, Т1)
 Кх (Е,Т1, Т2, К1)
Кх (Е,Т1, Т2, К1)
В области низких температур скорость подчиняется правилу Вант- Гоффа:
В области низких температур при повышении температуры на каждые 10 градусов возрастает скорость в кинетической области в 2÷4 раза в дифференциальной области в 1,1 ÷ 1,5 раза.

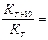 2÷4
2÷4  1,1 ÷ 1,5
1,1 ÷ 1,5
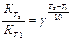

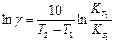
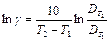
Необходимым условием для протекания химической реакции являются столкновения молекул или атомов. Если все реагирующие вещества находятся в газообразном состоянии, то, число столкновений, испытываемых каждой молекул газа, очень велико и достигает десятков миллиардов в секунду. Из этого следует, что в реакциях, протекающих с определенными скоростями, а не мгновенно, химическое взаимодействие вызывает какая – то малая часть столкновений.
Только те из сталкивающихся молекул вступают в химическое взаимодействие, которые обладают избыточной энергией. Это – так называемые активные молекулы. Соотношение между активными и неактивными молекулами определяется законом распределения Максвелла – Больцмана и выражается следующим уравнением:
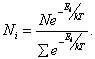
где Nакт – число активных молекул; Nобщ − общее число молекул; е − основание натурального логарифма;
Е − энергия активации, дж/моль (кал/моль); R − универсальная газовая постоянная; Т − абсолютная температура, о К
Из этого уравнения следует, чем выше температура и чем ниже энергия активации Е, тем больше число активных молекул Nакт, способных к химическому взаимодействию.
Таким образом, эффективными оказываются столкновения только между такими молекулами, которые к моменту столкновения обладают некоторыми избытками внутренней энергией по сравнению со средней для данной температуры величиной. Этот избыток энергии и характеризуется энергией активации.
На графике изменения энергии реагирующей системы. Если реакция прямая (переход из состояния 1 в состояние 2 является экзотермической реакцией), то общий запас энергии продуктов реакций меньше, чем исходных веществ, и система в результате этой реакции переходит на более низкий энергетический уровень. Разница уровней 1 и 2 численно равна тепловому эффекту реакции.
Уровень К определяет тот наименьший запас энергии, которым должны обладать молекулы, чтобы их столкновения могли привести к химической реакции. Разность между уровнем к и уровнем 1 представляет собой энергию активации Е1 прямой реакции, а разность между уровнем к и уровнем 2 – энергию активации Е2 обратной реакции. Таким образом, по пути от исходного состояния в конечное система должна перейти через своего рода энергетический барьер.
Очевидно, чем ниже этот барьер (уровень К), т.е. чем меньше энергия активации, тем большая доля молекул в каждый данный момент является способной к реакции и тем более высокой будет скорость реакции.
Энергия активации основной физико – химической реакции сталеплавильных процессов – реакции окисления углерода – составляет 147 -168 кдж/моль (35-40 ккал/моль). Зависимость скорости реакции в сталеплавильной ванне от концентрации реагирующих веществ, температуры и величины энергии активации можно представить следующим уравнением:
в экспоненциальной форме согласно уравнения (35)
К = lnВ 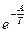 или К = Ко
или К = Ко  , а скорость:
, а скорость:
V = k (FeO)[C]e
(FeO)[C]e
где k - константа скорости окисления кислорода;
- константа скорости окисления кислорода;
(FeO) – концентрация FeO в слое шлака, соприкасающегося с металлом, % (по массе);
[C] – концентрация углерода в металле, % (по массе);
е – основание, натурального логарифма;
R – универсальная газовая постоянная;
Т – температура, о К.
При температурах сталеплавильных процессов скорость движения атомов (ионов) углерода и кислорода составляет примерно 240 м/сек. В этих условиях частица углерода имеет возможность около 100 раз в секунду столкнуться с частицей кислорода, т.е. реакция окисления углерода в сталеплавильной ванне имеет взрывной характер.
Сравнительно малые фактические скорости окисления углерода в сталеплавильной ванне обусловлены тем, что рассматриваемая реакция является сложной и ее скорость определяется скоростью наиболее медленной стадии. Последней является поступление кислорода в зону реакции. Лимитировать эту реакцию может также выделение окиси углерода из металла.
Явление изменения скорости химической реакции под влиянием веществ не являющихся реагентами называется катализом. Наряду с катализаторами, увеличивающими скорость реакции, имеются отрицательные катализаторы, называемые ингибиторами, которые замедляют реакции.
Реакции, протекающие вначале с небольшой скоростью, а затем постепенно ускоряющиеся, называются автокаталитическими. Такое явление, получившее название автокатализа, объясняется тем, что один из образующихся продуктов играет роль катализатора.
Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор образует одну фазу с реагирующей гомогенной системой. Гетерогенный катализ характерен тем, что катализатор образует обособленную фазу (например, синтез аммиака на платиновой сетке).
Для объяснения катализа предложено несколько различных теорий: химическая (теория промежуточных соединений), физическая (различные варианты адсорбционных теорий), электронная и цепная. В гомогенном катализе наибольшее распространение получила теория промежуточных соединений, развитая в работах Н.Д. Зелинского и его учеников. Основными в этой теории являются следующие положения:
1) катализатор активно вступает в химические реакции с исходными веществами, образуя неустойчивые промежуточные соединения, последующие превращения которых приводят к образованию необходимых продуктов реакции и регенерации катализатора;
2) химическое взаимодействие катализатора с исходными веществами изменяет термохимический путь реакции, в результате чего уменьшается энергия активации и увеличивается скорость реакции в случае отрицательного катализа.
Схему гомогенного катализа можно представить следующим образом:
А + В → АВ – реакция протекает медленно;
А + К → АК – реакция протекает быстро;
АК + В → АВ + К – реакция протекает быстро.
Реакция окисления сернистой кислоты в серную протекает по такой схеме:
2Н2SО3 + О2 = 2Н2 SО4 - реакция протекает медленно;
О2 + 2NO = 2NO2 – реакция протекает быстро;
NO2 + Н2SО3 = Н2SО4 + NO – реакция протекает быстро.
Катализатором в данном случае является окись азота NO, а промежуточным соединением – двуокись азота NO2.
При изучении механизма гетерогенного катализа большое значение имеют два положения, обоснованные опытными данными:
1) Катализ связан с адсорбцией реагирующих веществ на поверхности раздела фаз;
2) В каталитической реакции принимает участие не вся поверхность катализатора, а лишь часть ее, составленная из совокупности отдельных участков, называемых активными центрами.
В настоящее время существует несколько теорий, объясняющих строение активных центров и явление гетерогенного катализа. Так, согласно мультиплетной теории А.А. Баландина, активными центрами на поверхности катализатора являются мультиплеты. Последнее представляет собой совокупность двух, трех или шести поверхностных атомов катализатора, которые участвуют в акте химического превращения, протекающего его поверхности.
Согласно теории мультиплетов, места, к которым прикрепляются превращаемые молекулы, расположены на поверхности катализатора геометрически правильно, соответственно расположению атомов в кристаллической решетке. Если около активного центра закрепляются два атома, то между ними может возникнуть химическая связь, при этом связь этих атомов с другими атомами значительно ослабевает. Таким образом, создаются предпосылки для химического превращения.
Цепная теория катализа, развитая Н.Н. Семеновым и В.В. Воеводским, основана на том, что на поверхности катализатора имеются свободные положительные и отрицательные валентности, взаимодействие которых с валентно насыщенными молекулами исходных веществ приводит к образованию радикалов. Последние активно вступают в реакции с другими адсорбированным на поверхности радикалами м с молекулами газовой или жидкой фазы.
В основе электронной теории катализа лежит представление о том, что свободная или слабосвязанная электроны катализатора делают его радикалоподобным, в результате чего обеспечивается ускорение реакции, протекающей на поверхности катализатора.
Активность катализатора зависит от многих факторов. При неизменных условиях скорость каталитической реакции пропорционально количеству катализатора (для небольших количеств). Так, скорость реакции разложения перекиси водорода в присутствии иода (гомогенный катализ), которая протекает в две стадии по термохимическим уравнениям:
Н2О2 + I2 = 2НI + О2
Н2О2 + 2НI = 2Н2О + I2
Пропорциональна количеству иода.
Активность катализатора может быть резко повышена или понижена различными добавками. Добавки. Увеличивающие активность катализатора, называются промоторами или активаторами, а сам процесс повышения активностей добавками катализаторов называется промотированием. Так, активность никелевого катализатора по отношению к реакции гидрирования СО до СН4 увеличивается в 10 раз после добавления к нему 0,5 % окиси церия (СеО) или окиси тория (ТҺ).
При гетерогенном катализе катализатор работает только своей поверхностью, которая по количеству составляет небольшую часть от всей массы катализатора. Для экономии таких катализаторов, как платина (Pt), золото (Au), серебро (Ag), осмий (Os), иридий (Ir) и другие применяются так называемые адсорбционные (наносные) катализаторы, получаемые путем нанесения их на пористые или малоактивные вещества – уголь, пемзу, силикогель, алюмогель, тальк, асбест и др.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1043; Нарушение авторских прав?; Мы поможем в написании вашей работы!