
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дидактические единицы. Горение; диссоциация газов
|
|
|
|
Горение; диссоциация газов.
1. Процессы горения широко используются в промышленности, в частности в металлургии, для получения топлива и высоких температур, так как реакции горения сопровождаются значительным выделением тепла и протекают достаточно быстро.
В узком смысле под горением понимают реакции взаимодействия веществ с кислородом, источником которого чаще всего служит атмосферный воздух. Значительные перспективы имеет применение технически чистого кислорода и его смесей с воздухом.
Обычно в качестве топлива используют горючие вещества органического происхождения, т. к. они удовлетворяют основным требованиям, предъявляемым к техническому топливу:
– значительный тепловой эффект реакции окисления элементов (углерода и водорода, входящих в органическое вещество)
– распространенность в природе
– невысокая стоимость
– газообразное состояние и относительная безвредность реакции.
Газы, получающиеся при горении, обычно активно участвуют в металлургических процессах.
Из всех видов топлива в черной металлургии наибольшие значение имеют каменноугольный кокс – основное горючие в доменном производстве, а также горючие газы (доменный, коксовальный, генераторный, природный) и мазут, применяемые в мартеновском производстве и в различных нагревательных устройствах.
В твердом топливе важнейшей горючей составляющей является углерод, а в газообразном окись углерода и водород. Последней в заметных количествах содержится также в твердом и жидком топливе. В горючих газах водород находится как в свободном состоянии, так и в различных соединениях (углеводороды и т.п.)
Таким образом, химическая сторона горения топлива сводится главным образом к многочисленным реакциям взаимодействия углерода, водорода и соединений, содержащих эти элементы с кислородом.
В настоящем курсе рассмотрим наиболее важные для металлургии реакции в системах углерод – кислород и углерод – кислород – водород:
1. Неполное горение углерода: 2С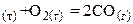
2. Полное горение углерода: С
3. Горение окиси углерода СО: 2СО
4. Взаимодействие двуокиси углерода 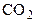 с углеродом:
с углеродом: 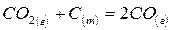
5. Горение водорода: 2
6. Взаимодействие водяного пара с углеродом: С
7. То же: С
8. Реакция водяного газа: С
Среди них реакции 3, 5 и 8 гомогенные и протекают в пределах газообразной фазы. Остальные гетерогенные, в которых твердый углерод взаимодействует с кислород содержащими газами.
§2. Главные компоненты горючих газов – водород, окись углерода и метан.
К газовым реакциям, имеющим большое значение в металлургических процессах, относится горение окиси углерода и водорода. В качестве окислителя метана при конвертировании применяются водяные пары и двуокись углерода. При термодинамическом анализе газовых реакций большое значение имеет изучение реакций водяного пара.
Горение газов – водорода, окиси углерода и метана – описывается следующими простыми уравнениями:
2Н2 + О2 ↔ 2Н2О ∆Н = - 484 660 кДж;
= - 484 660 кДж;
2СО + О2 ↔ 2СО2 ∆Н = - 566 350 кДж;
= - 566 350 кДж;
СН4 + 2О2 ↔ 2СО2 + 2Н2О ∆Н = - 806 000 кДж; (9)
= - 806 000 кДж; (9)
На основе уравнений (1-3) рассчитываются количество кислорода и воздуха, необходимых для горения, а также объем образующихся продуктов сгорания. Вместе с тем эти уравнения необходимо рассматривать лишь как итоговое выражение несравненно более сложного процесса.
Экспериментальные исследования и термодинамические данные свидетельствуют об обратимости реакций горения водорода, окиси углерода и метана, а также о достаточно высоких скоростях установившегося конечного равновесного состояния при высоких температурах.
При горении водорода и окиси углерода газовые смеси Н2О, Н2, О2 и СО2, СО, и О2 являются однофазными (Ф= 1). При двух компонентах (К = 2) число степеней свободы для этих газовых смесей в соответствии с правилом фаз составит.
Правило (закон фаз)
С = К – Ф + 2 (Т, сi)
или
С = 2 – 1 + 2 = 3
Где Ф – фаза; К – компонент; С - число степеней свободы
При наличии трех степеней свободы конечное состояние реакции горения водорода и окиси углерода и равновесный состав газовой смеси определяются тремя независимыми переменными: температурой, давлением и концентрацией газовой фазы.
Пользуясь принципом Ле – Шателье, выясним влияние температуры и давления на смещение равновесия. Реакций экзотермические следовательно, с повышением температуры при постоянном давлении равновесие смещается влево, в сторону диссоциации СО2 и Н2О (равновесные концентрации СО2 и Н2О уменьшаются, а О2 увеличивается). Образование СО2 и Н2О сопровождается уменьшением объема, и повышения давления при постоянной температуре приводят к смещению равновесия вправо.
Таким образом, выясняется, что [%]О2 (р) увеличивается с ростом температуры и с уменьшением давления. Однако принцип Ле – Шателье, как правило фаз, являясь качественными значениями, не дают никаких указаний о количественных соотношениях между рассматриваемыми величинами.
3. В металлургических процессах газы находятся при давлениях, несильно отличающихся от атмосферного при сравнительно высоких температурах.
Константы равновесия рассмотренных реакций определяются из следующих соотношений по 2 ЗДМ:
 (1)
(1)
 (2)
(2)
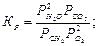 (3)
(3)
Тогда равновесные парциальные давления кислорода определяются из уравнений (1÷3):
 (4)
(4)
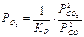 (5)
(5)
 (6)
(6)
Согласно 2 ЗДМ константа равновесия не зависит от давления и является лишь функцией от температуры КР = ƒ(т), но зависит от четырех переменных: температуры, давления в системе и парциальных давлений (концентраций) других реагентов. Однако давления (концентрация) только одного компонента является независимой, поэтому давление (концентрация) кислорода в соответствии с правилом фаз является функцией трех переменных.
Обычно для сжигания газов применяют атмосферный воздух или воздух, обогащенный кислородом. В этих случаях в систему вводится еще один компонент – азот и она становится четырехвалентной. Для однозначного определения равновесного состава газа необходимо дополнительное условие, связанное с концентрациями, например, указание состава исходного газа, в котором фиксировано соотношение концентраций азота и кислорода.
Введение азота при постоянных Робщ и Т влияет на равновесный состав газа так же, уменьшение давления (равновесие смещается влево).
4. Для выяснения направления реакции в заданных условиях воспользуемся уравнением.
Для решения вопроса о принципиальной возможности или невозможности того или иного физико-химического процесса необходимо прежде всего установить, является ли интересующая нас система при заданных условиях (температуре, реакции, концентрациях) равновесной или неравновесной. В последнем случае следует выяснить, по какую сторону от равновесия находятся система и насколько она удалена от него.
В изобарно-изотермических процессах обо всем судят по знаку и величине изменения изобарно – изотермического потенциала (∆G), определяемым из уравнения изотермы химической реакции Вант – Гоффа:
∆GT = -RT (ln Ka -∆lnПаi) (1)
В частном случае для идеальных газов
∆GT = - RT (ln KР - ∆lnПРi) (2)
где ∆GT – изменение изобарного потенциала при определенной температуре Т и произвольно выбранных активностях (концентрациях) реагентов. Ka – константа химического взаимодействия при той же температуре. П а i – произведение активностей (концентраций) – выражение построенное подобно константе химического равновесия, только вместо равновесных активностей (концентраций) здесь фигурируют фактические в исходном неравновесном состоянии.
Знак и величина ∆GT зависят от количественного соотношения между П а i – произведением активностей компонентов или давлений и константой равновесия Ka или KР.
Именно уравнение (1) позволяет выявить знак ∆GT, а значит определить направление самопроизвольного протекания реакций (при Р,Т = соnst):
Для выяснения направления реакций в заданных условиях воспользуемся уравнением изотермы (2) имеющем, применительно к рассматриваемым системам следующий вид:
∆GT = - RT  (3)
(3)
∆GT = - RT  (4)
(4)
∆GT = - RT 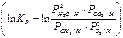 (5)
(5)
Для протекания реакции горения рассматриваемых газов вправо необходимо при заданной температуре взять также исходные неравновесные концентрации реагентов чтобы значение изобарного потенциала исходных реагентов было больше, чем у продуктов реакций. Иными словами, чтобы реакции могли идти в сторону образования продуктов (вправо), числитель ПРi должен быть меньше, а знаменатель больше чем в равновесном состоянии. Для этого нужно взять такую неравновесную газовую смесь, в которой концентрации (парциальные давления) были бы меньше, а концентрации продуктов больше равновесных: G < O
Подобными рассуждениями приходим к выводу, что диссоциация СО2 и Н2О возможны лишь тогда, когда газовая смесь имеет избыток СО2 и Н2О в сравнении с равновесными концентрациями.
Реакции экзотермические (∆Н < 0), следовательно, константа равновесия (произведение равновесных концентраций) должна убывать с повышением температуры (см. уравнения 2,1). Зависимость константы равновесия экзотермической реакции от температуры. Кривая делит поле диаграммы на две области: в верхней части (ПРi>KР) располагаются точки, отвечающие неравновесным системам, в которых реакция может протекать в сторону диссоциации двуокиси углерода, а в нижней части в сторону ее образования.
Значения ln KР при разных температурах (табл. 1) рассчитаны по эмпирическому уравнению типа
ln K =
Так для реакции 2 горения окиси углерода:
lgKР=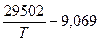 или lnKР/2 =
или lnKР/2 =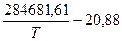 (6)
(6)
С учетом уравнения нормального сродства
 (7)
(7)
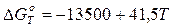 [кал] (8)
[кал] (8)
или
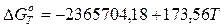 [Дж] (9)
[Дж] (9)
Из данных таблицы 1 для рассматриваемой реакции следует, что температура весьма существенно сказывается на изменении константы равновесия.
Так, при повышении температуры Т от 500 до 2000о КР уменьшается примерно в 1044 раз, что объясняется большой абсолютной величиной теплового эффекта.
Значение логарифма константы равновесия реакции горения окиси углерода (КР) и водорода (КР) при разных температурах.
Таблица 1
| Т,о К | (2) lg KР | ln KР | (1) lg KР | ln KР |
| 49,93 | 114,99 | 46,57 | 107,25 | |
| 20,43 | 47,05 | 20,19 | 46,50 | |
| 18,18 | 41,87 | 18,18 | 41,87 | |
| 10,58 | 24,36 | 11,42 | 26,30 | |
| 5,68 | 13,08 | 7,03 | 16,19 | |
| 2,73 | 6,29 | 4,40 | 10,13 | |
| 0,76 | 1,75 | 2,63 | 6,07 |
Далее, несмотря на столь значительное уменьшение константы равновесия, ее численное значение вплоть до высоких температур (более 2000о С) остается существенно большим единицы (105 и более), следовательно в широком интервале температур равновесие практически полностью смещено вправо и реакция необратима.
Таким образом, реакцию горения окиси углерода вплоть до температур порядка 2000о К можно считать практически необратимой, идущей при благоприятных условиях до конца.
Значения lg KР горения водорода вычислены по эмпирическому уравнению:
lg KР =  (10)
(10)
или
ln KР =  (11)
(11)
Приведены в табл. 1, откуда видно, что вплоть до 2000о К. Кр >> 1 то есть реакция 2 равно как и реакция 1 необратима в широком интервале температур.
Наряду с общим моментами, между реакциями 1 и 2 в их термодинамических характеристиках имеются в различия.
Как уже указывалось, тепловые эффекты рассматриваемых превращений одного знака и одного порядка, но они все же не одинаковы, и температура в различной степени влияет на изменение константы равновесия.
Из анализа данных таблицы 1 следует, что:
- Константа равновесия реакции 2 убывает с температурой интенсивнее, чем реакция 1. Это в соответствии с уравнением изобары
 (12)
(12)
объясняется тем, что по абсолютной величине ΔН2 > Н1
- При 1083о К (810оС) и К1 = К2. Отсюда:
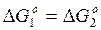 и Р
и Р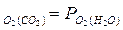
Иначе говоря, при 810оС и одинаковых исходных концентрациях окись углерода и водород обладают одинаковым сродством к кислороду, или двуокись углерода и водяной пар одинаковы прочны.
В области температур выше 810оС К1 > К2.
 , а
, а  ,
,
т.е. при высоких температурах и аналогичных условиях по исходным концентрациям водород обладает большим сродством к кислороду, чем СО или Н2О, прочнее, чем СО2.
В области температур ниже 810оС получаются обратные соотношения.
Рассмотрим данные химического сродства для реакций (1) и (2)
Таблица 2:
| № п/п | Реакция | Температура, 0К | |||||||||||
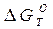 , кДж , кДж
| |||||||||||||
| 2Н2+О2↔2Н2О | |||||||||||||
| 2СО+ О2↔2СО2 | |||||||||||||
Для реакций 1 и 2 С.И. Филиппов рекомендует соответственно следующие уравнения, по которым можно рассчитать значения логарифмов констант равновесия и изменений изобарных потенциалов (табл. 2):
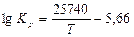 (13)
(13)
 кДж (14)
кДж (14)
 (15)
(15)
 кДж (16)
кДж (16)
По данным таблице 2 рис.1 построена графическая зависимость 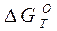 от температуры для реакции образования Н2О и СО2. При относительно низких температурах рассматриваемые химические реакции характеризуются достаточно высокими отрицательными численными значениями
от температуры для реакции образования Н2О и СО2. При относительно низких температурах рассматриваемые химические реакции характеризуются достаточно высокими отрицательными численными значениями  , что свидетельствует о значительном химическом сродстве водорода и окиси углерода к кислороду в реакциях горения, а также о высокой прочности Н2О и СО2.
, что свидетельствует о значительном химическом сродстве водорода и окиси углерода к кислороду в реакциях горения, а также о высокой прочности Н2О и СО2.
С повышением температуры наблюдается понижение прочности Н2О и СО2. В точке пересечения прямых при температуре 1093 К значения  и
и 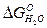 равны. Это указывает на одинаковую прочность Н2О и СО2 и одинаковую способность Н2 и СО связывать кислород. При Т < 1093 К
равны. Это указывает на одинаковую прочность Н2О и СО2 и одинаковую способность Н2 и СО связывать кислород. При Т < 1093 К  , восстановительная способность СО и его сродство к кислороду выше, чем у Н2. При Т > 1093 К
, восстановительная способность СО и его сродство к кислороду выше, чем у Н2. При Т > 1093 К 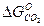 >
>  , прочность Н2О больше, чем СО2, восстановительная способность Н2 выше, чем СО.
, прочность Н2О больше, чем СО2, восстановительная способность Н2 выше, чем СО.
Реакции горения водорода и окиси углерода в случае протекания их при низких температурах можно считать практически необратимыми. При более высоких температурах становится заметной диссоциация СО2 и Н2О, и в продуктах горения появляются окись углерода, кислород, водород и гидроксильные радикалы. Такие соотношения в составе газовой фазы обусловлены тем, что с повышением температуры понижается сродство СО и обусловлены тем, что с повышением температуры понижается сродство СО и Н2 к кислороду. Таким образом, следствием различной прочности Н2О и СО2 оказывается их различная окислительная способность в интервале температур до 1093о К и выше этой температуры. В согласии с раннее отмеченным наблюдается относительно небольшое влияние давления. Тем не менее разрежение в реакционном пространстве содействует при Т = const диссоциации Н2О (СО2) или препятствует более полном завершения процесса горения.

Рис.1. Температурная зависимость
 реакций образования СО2 и Н2О.
реакций образования СО2 и Н2О.
5. Смесь из углеродсодержащих газов (СО и СО2) в зависимости от ее состава по отношению к различным элементам восстановительной или окислительной.
В металлургических процессах необходимо знать восстановительную способность указанной смеси, определяемую сродством СО к кислороду (т.е. способностью СО и О2 вступать во взаимодействие), или ее окислительную способность (окислительный потенциал) – стремление СО2 к диссоциации.
Оба эти свойства характеризуется в общем случае величиной ΔG, а при фиксированном соотношении между концентрациями СО и СО2 – величиной равновесного парциального давления О2 - Р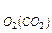 в рассмотренной реакции
в рассмотренной реакции
 (1)
(1)
Отсюда следует:
- Для газовой смеси с постоянном соотношением между концентрациями СО и СО2 величина Кр и ΔGо служат мерой сравнительной прочности СО2 или сродства СО к О2.
- С увеличением температуры Кр уменьшается, а Р растет т.к. при этом уменьшается ΔGо, то увеличение равновесного парциального давление О2 означает уменьшение прочности СО2 или сродства СО к О2.
растет т.к. при этом уменьшается ΔGо, то увеличение равновесного парциального давление О2 означает уменьшение прочности СО2 или сродства СО к О2.
- При постоянной температуре Р определяется соотношением:
определяется соотношением:  к РСО.
к РСО.
Как оказывается давление свободного кислорода в системе, и окислительные свойства атмосферы находятся в определенной зависимости от содержания других компонентов. В этом проявляется роль концентрационного фактора, отмеченного ранее в качественной форме. Давлению кислорода в конечной равновесной смеси отвечает строго определенное соотношение 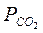 / РСО. Возрастание окислительных свойств газовой фазы неизбежно связано с увеличением содержании в ней СО2 и уменьшением СО. Зная числовые значения Кр, можно определить по соотношению
/ РСО. Возрастание окислительных свойств газовой фазы неизбежно связано с увеличением содержании в ней СО2 и уменьшением СО. Зная числовые значения Кр, можно определить по соотношению  / РСО или наоборот.
/ РСО или наоборот.
В условиях, когда отношение  /РСО поддерживается постоянным,
/РСО поддерживается постоянным,  изменяется только в связи с изменением Кр (ΔGо) под влиянием температуры и отражает химическую природу диссоциирующей СО2, ее прочность. Последняя падает с ростом температуры, так как уменьшается числовое значение Кр.
изменяется только в связи с изменением Кр (ΔGо) под влиянием температуры и отражает химическую природу диссоциирующей СО2, ее прочность. Последняя падает с ростом температуры, так как уменьшается числовое значение Кр.
Для термодинамической характеристики состава и свойств газовой фазы можно привлечь величину химического потенциала компонента μ, измеренную относительно стандартного состояния μ0. Разность химических потенциалов кислорода между стандартным состоянием при давлении Р = 1 и любым другим с давлением Р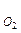 получила название кислородного потенциала.
получила название кислородного потенциала.
По=Δμ=RTlnP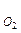 (2)
(2)
Величина кислородного потенциала По оказывается равной изменению изобарного потенциала системы при изотермическом переходе моля кислорода от давления Р = 1 до уровня P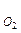 :
:
По=ΔGo (3)
и допускает сопоставление состава и свойств газовой фазы с другими кислородосодержащими системами в масштабе изменений ΔGo. Из уравнения 1 легко получить выражение кислородного потенциала или через давление кислорода, или через отношение  / РСО газовой фазы:
/ РСО газовой фазы:
По=Δμ=RTlnP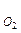 =2RTln
=2RTln /РСО–RTlnKР/2 (4)
/РСО–RTlnKР/2 (4)
На этом основании можно построить график температурной зависимости кислородного потенциала для газовых смесей различного состава и проводить наглядный графический анализ.
§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
1 → Н2О + СО ↔ Н2 + СО2; ΔН = - 40 840 кДж (1)
= - 40 840 кДж (1)
Ниже приведены вычисленные значения ΔН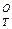 реакции водяного газа для различных температур
реакции водяного газа для различных температур
Т.К. 500 1000 1500 2000
ΔН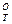 , кДж - 40350 – 35170 – 29180 – 26700
, кДж - 40350 – 35170 – 29180 – 26700
При повышении температуры равновесие реакций водяного газа смещается в сторону образования исходных веществ (водяных паров и окиси углерода), понижение температуры сопровождается развитием экзотермической реакции и образованием дополнительного количества водорода и двуокиси углерода. Равновесный состав газовой фазы реакции водяного газа в соответствии с принципом Ле – Шателье не зависит от давления, так как объем исходных веществ и продуктов реакций не изменяется. Константа равновесия реакций 1 выражается уравнением
Кр=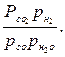 (2)
(2)
Вследствие небольшого теплого эффекта реакции 1 влияние температуры на величину Кр незначительно. Реакция водяного газа является однофазной и при трех компонентах К характеризуется четырьмя степенями свободы:
С=К+Ф+2=3-1+2=4. (3)
Конечный состав газовой фазы при равновесии реакции 1. определяется четырьмя независимыми переменными:
РСО = ƒ(Т,РН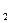 Р
Р Р
Р )
)
С. И. Филиппов на основе обобщения имеющихся данных рекомендует следующие уравнения для расчета значений  и lnКр реакции водяного газа 1:
и lnКр реакции водяного газа 1:
интервал температур 500—1200 К:
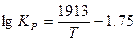
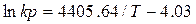 (4)
(4)
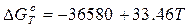 кДж (5)
кДж (5)
интервал температур 1300—1800 К
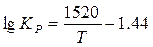
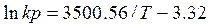 (6)
(6)
 кДж (7)
кДж (7)
В константу равновесия реакции водяного газа входят четыре переменных Рн2о, РСО, Рсо2, Рнг. Вместе с тем для определения равновесного состава газа имеются только два уравнения:

 (8)
(8)
В действительности каждой определенной температуре соответствует одно значение Кр и множество равновесных составов газовой фазы, которые подчиняются определенной закономерности.
Примем следующие обозначения отношений равновесных парциальных давлений:

 (9)
(9)
По величине этих отношений можно определить степень превращения СО в СО2 и Н2 в Н2О. Чем больше величина а, тем большее количество окиси углерода оставалось непрореагировавшим. Такая зависимость справедлива и для водорода: величина в характеризует число оставшихся молекул водорода на каждую молекулу водяного пара.
Введем в газовую смесь, состоящую из 50% окиси углерода и 50% водорода, количество кислорода, недостаточное для полного окисления СО и Н2. После установления равновесия газовая фаза будет содержать СО2, Н20, СО и Н2 в таких концентрациях, которые определяются термодинамикой реакции водяного газа.
Потребителями кислорода в изучаемой системе являются СО и Н2. При этом в зависимости от температуры преобладающая доля кислорода будет взаимодействовать с тем газом, у которого сродство к кислороду больше. Как указывалось ранее, при температурах ниже 1093 К сродство окиси углерода к кислороду больше, чем водорода. Из этого следует, что количество окиси углерода, превратившейся в СО2, превысит количество водорода, окислившегося в Н2О. Таким образом, равновесный состав газовой смеси будет определяться относительно малой величиной а и большей величиной в. Температуры выше 1093 К характерны тем, что водород обладает большим сродством к кислороду и а > в. При температуре 1093 К сродство водорода и окиси углерода к кислороду одинаковое и а =в.. Константу равновесия реакции 1 можно записать так:
 (10)
(10)
или
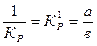 (11)
(11)
Тогда
 (12)
(12)
Из уравнения следует, что зависимость между рассматриваемыми величинами описывается уравнением прямой, выходящей из начала координат, а константа К'р является тангенсом угла наклона к оси абсцисс.
Значения констант равновесия реакции водяного газа могут быть вычислены по равновесным концентрациям этих газов или по их парциальным давлениям. Величина констант равновесия не зависит от того, в каких единицах выражены концентрации и парциальные давления.
Термодинамические характеристики реакции водяного газа важны не только для анализа процессов горения. Ими пользуются при изучении окислительно-восстановительных процессов в газовых смесях СО—С02 и Н2—Н2О. Если в смесь, состоящую из 50% СО и 50% Н2, внести Fе2Оз, то при определенных температурах начнется процесс восстановления: температура ниже 1093 К — окись углерода произведет больший объем восстановительной работы и а<в; температура выше 1093 К — равновесие реакции удовлетворяет условию а > в, что свидетельствует о большем объеме восстановительной работы, выполненной водородом.
В смеси, состоящей из 50% СО2 и 50% Н2О, внесенное металлическое железо окисляется с переходом СО2 и Н2О в СО и Н2. В условиях низких температур (ниже 1093К) больший объем окислительной работы выполняет водяной пар, так как а < в, в условиях высоких температур (выше 1093 К)—углекислый газ (а>в),
Величины К р и ∆G реакции водяного газа определяются такими же величинами частных реакций диссоциации СО2 и Н2О. Сродство СО к кислороду больше, чем к Н2, и в газовой фазе повышается относительное содержание водорода.
реакции водяного газа определяются такими же величинами частных реакций диссоциации СО2 и Н2О. Сродство СО к кислороду больше, чем к Н2, и в газовой фазе повышается относительное содержание водорода.
При 1093 К имеет место равенство химического сродства СО и Н2 к кислороду. Увеличение содержания СО в газовой фазе обусловлено более высоким химическим сродством водорода к кислороду. В газовой фазе, содержащей СО2,СО, О2 или Н2О, Н2, О2 изменением состава изменяются ее окислительно-восстановительные свойства.
Количественной мерой окислительных свойств газовой фазы может служить ее кислородный потенциал или величина упругости диссоциации СО2 и Н2О. Окислительные свойства газовой смеси возрастают с повышением содержания в ней СО2 и уменьшением содержания СО.
В реакции водяного газа кислород в газовой фазе появляется в результате диссоциации СО2 и Н2О. Наличие кислорода характеризует окислительно-восстановительные свойства многокомпонентной газовой смеси. Если константу равновесия реакции водяного газа 1 записать в виде соотношения

и подставить в него выражение константы равновесия реакции водяного пара,получим

Каждое из соотношений Рсо/Рсо2 и Р /Р
/Р характеризует в качественной форме окислительные свойства сложной газовой фазы, дает представление о влиянии атмосферы по отношению к различным металлам и их окислам и позволяет подбирать составы безокислительных или нейтральных газовых смесей.
характеризует в качественной форме окислительные свойства сложной газовой фазы, дает представление о влиянии атмосферы по отношению к различным металлам и их окислам и позволяет подбирать составы безокислительных или нейтральных газовых смесей.
§7. Природный газ, состоящий в основном из метана, используется в огромных количествах для энергетических целей, получения чистого водорода, в химии органического синтеза и в металлургии. При нагревании метан разлагается. Рассмотрим обратимую реакцию образования и разложения метана:
1→ С+2Н2 ↔СН4
Выражение константы равновесия и уравнение температурной зависимости константы равновесия реакции разложения метана могут быть записаны в следующем виде:
 (1)
(1)
и
 (2)
(2)
Равновесный состав газовой смеси, образующейся при диссоциации метана (Р = 101,3 кПа), приведен в табл. 3, из которой видно, что заметное разложение метана начинается при 300 С, а при 1000°С метан может разлагаться практически полностью. Из приведенных данных также следует, что пониженные температуры благоприятны для образования метана из углерода и водорода. Реакция 1 протекает с изменением объема и равновесие ее зависит от давления. С увеличением давления развивается прямая реакция.
Таблица 3
| Температура, 0С | Состав смеси, об. % | Температура, 0 С | Состав смеси, об. % | ||
| СН | Н2 | СН4 | Н2 | ||
| 94,90 86,16 69,86 62,53 60,71 51,16 46,69 | 5,10 13,84 30,14 37,47 32,29 48,84 53,31 | 41,26 31,68 11,07 4,41 0,50 0,20 0,10 | 58,74 68,32 88,93 95,59 99,50 99,80 99,90 |
При горении метана в окислитеяьной среде протекают следующие реакции:
2→ СН4 + 2О2 = СО2 + 2Н2О
3→ СН4 +  О2 = СО + 2Н2
О2 = СО + 2Н2
Экспериментальные данные показывают, что метан предрасположен не только к крекингу, но при определенных условиях и к конвертированию и реформированию. К конвертированию относятся реакции взаимодействия метана с водяными парами и углекислым газом:
4→СН4+ Н2О↔ СО + 3Н2
5→ СН4+ 2Н2О↔ СО2 + 4Н2
6→ СН4+ СО2↔ 2СО + 2Н2
При горении природного газа с недостатком воздуха происходит процесс реформировация газа, сопровождающийся изменением его состава и выделением частиц сажистого углерода. Последние значительно повышают светимость факела в мартеновских печах, отапливаемых реформированным природным газом, при этом ускоряется нагрев металла.
Для ряда технологических факторов целесообразно в качестве газа-восстановителя применять конвертированный газ, получаемый из метана — природного газа. Парогазовая смесь, включающая 50% природного газа и 50% водяного пара, при наличии никелевого катализатора нагревается до 1100°С. В этих условиях происходит реакция 2, в результате которой образуется газ-восстановитель, состоящий из 74—75% водорода, 22—23% окиси углерода и незначительного количества углекислого газа и паров воды. Значения логарифмов констант равновесия реакций диссоциации и конвертирования метана даны в табл.4.
Таблица 4
| Т, К | СН4↔С+2Н2 | СН4+СО2↔2СО+2Н2 | СН4+Н2О↔СО+3Н2 | СН4+2Н2О↔СО+4Н2 |
| 298,26 | -8,899 -3,428 -0,167 1,009 2,104 2,579 3,403 3,886 4,207 | -29,920 -12,219 -2,151 1,246 4,381 5,765 7,985 9,281 10,120 | -24,920 -10,082 -1,525 1,401 4,134 5,350 7,322 8,488 9,150 | -19,904 -7,944 -0,900 1,557 3,886 4,936 6,659 7,694 8,380 |
Вычислим по приведенным термодинамическим потенциалам константу равновесия реакции конвертирования метана водяным паром при 1000К, используя уравнение (2).
СН4+ Н2О↔ СО + 3Н2
Из работы выпишем необходимые значения  и
и  для 1000К. При вычислении суммарной реакции Л величины функций для водорода умножаются на три, так как в результате реакции образуется три моля водорода:
для 1000К. При вычислении суммарной реакции Л величины функций для водорода умножаются на три, так как в результате реакции образуется три моля водорода:
СН4 Н2О СО Н2 ∆
 Дж/(моль/град) -199,313 -196,744 -204,074 -136,963 -218,911
Дж/(моль/град) -199,313 -196,744 -204,074 -136,963 -218,911
Н кДж/моль -66,965 -238,906 -113,880 0 -191,991
кДж/моль -66,965 -238,906 -113,880 0 -191,991
Определим значения ∆ и ∆
и ∆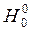
∆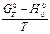
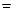



-204079-3∙136963+199313+196744= -218911 кДж
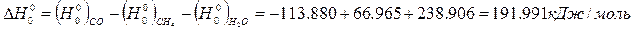
Значения константы равновесия реакции 4 находятся по уравнению:
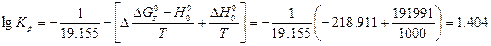
Так же вычислим константу равновесия для реакции конверсии метана углекислым газом при 1273 К.
СН4+ СО2↔ 2СО + 2Н2
В работе приводятся значения 
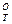 —
—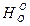 /Т для веществ, участвующих в реакции при Т = 1000 и 1500 К. Требуется рассчитать константу равновесия при 1273 К. Соответствующие значения находятся интерполяцией:
/Т для веществ, участвующих в реакции при Т = 1000 и 1500 К. Требуется рассчитать константу равновесия при 1273 К. Соответствующие значения находятся интерполяцией:
СН4 СО2 СО Н2 ∆
G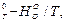 Дж/(моль*град) -211,123 -235,990 -210,939 -143,483 -261,731
Дж/(моль*град) -211,123 -235,990 -210,939 -143,483 -261,731
Н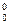 ,кДж/моль -66,965 -393,229 -113,880 0
,кДж/моль -66,965 -393,229 -113,880 0
Oпределим значения  —
—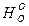 /Т,
/Т, 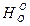
∆
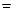


 =2∙210,939-2∙1,43483+211,123+235,990=-261,731 Дж/(моль∙град)
=2∙210,939-2∙1,43483+211,123+235,990=-261,731 Дж/(моль∙град)
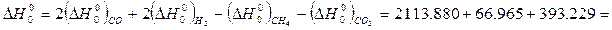
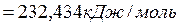
По уравнению вычислим:

Результаты сопоставления расчетных величин констант равновесия реакций конверсии метана водяным паром и углекислым газом с данными табл. 2 показывают, что они совпадают.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1139; Нарушение авторских прав?; Мы поможем в написании вашей работы!