
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Какая стадия является лимитирующей для последовательных процессов?
|
|
|
|
Блиц – тест
Глоссарии
Диссоциация химических соединении – это распад сложных веществ, с образованием простых компонентов
Горение углерода – это процесс окисления углерода кислородом воздуха.
| 1. Что называется коэффициентом массопередачи? Коэффициентом массопередачи называется: |
| A. скорость переноса массы реагентов в ходе гетерогенного процесса B. скорость переноса массы реагентов при изменении концентрации на единицу C. перенос массы реагентов в единицу времени D. скорость реагентов при градиенте концентрации равной единице E. скорость подвода и отвода реагентов в реакционную зону |
| 2. Что называется градиентом концентрации? Градиентом концентрации называется: |
| A. изменение концентрации реагентов в момент времени B. изменение концентрации с изменением температуры процесса C. исходная концентрация реагентов D. изменение концентрации реагентов в ходе процесса E. изменение концентрации реагентов в данном направлении |
| 3. Что называется молекулярной диффузией? Молекулярной диффузией называется диффузия, осуществляемая за счет: |
| A. направленного движения частиц B. теплового движения частиц C. переноса реагентов в реакционную зону как тепловым движением так и потоком D. самопроизвольное выравнивание концентрации E. механического движения частиц реагентов |
| 4. Что называется массопередачей (массопереносом)? Массопередачей называется процесс: |
| A. переноса реагентов в реакционную зону в ходе гетерогенных процессов B. изменения концентрации реагентов в реакционной зоне C. изменения массы реагентов с образованием продуктов реакции D. переноса реагентов потоком E. переноса реагентов за счет теплового режима |
| 5. Что называется адсорбцией? |
| A. накопление одного вещества в объеме другого B. накопление одного вещества на поверхности другого C. накопление одного вещества в другом D. накопление продуктов реакции в ходе процесса E. накопление реагентов реакции в ходе процесса |
A. стадия с минимальной скоростью
B. завершающая стадия
C. стадия с максимальной скоростью
D. промежуточная стадия начальная стадия
| 7. Что называется порядком реакции? Порядком реакции называется: |
| A. число молекул в элементарном акте реакции B. число молекул, участвующих химической реакции C. суммарный показатель степени при концентрации в 1 законе действующих масс D. число молекул реагентов, участвующих в элементарном акте химической реакции E. показатель степени при концентрации в кинетическом уравнении скорости химической реакции |
Литература:
- Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
- Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
- Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
- Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
- Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
- Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
- Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
- Симбинова К.Ж. Методические рекомендации по выполнению лабораторных работ. Алма-Ата, 1990, 75 с.
Лекции №5 «Механизм и кинетика окисления твёрдых металлов»
План лекции:
| восстановительные процессы. 2.Термодинамические основы процессов восстановления. 3. Восстановление поведения восстановителей, возможности их использования. |
1.Газообразными твёрдыми и металлическими восстановителями. Особенности
4.Кинетические особенности восстановления газом восстановителем и твердым углеродом.
Цель лекции:
Ознакомление с механизмом и кинетикой окисления твердых металлов
Дидактические единицы:
Восстановитель; окисление
1. При изучении гомогенных газовых реакций установлено, что многие из них, в том числе и газовые реакции горения, вступают в кажущееся противоречие с основными законами классической кинетики — с законом действующих масс и законом Аррениуса. Так, в некоторых реакциях в изотермических условиях наблюдается самоускорение, что противоречит закону Аррениуса. В отдельных реакциях обнаруживается тормозящее или ускоряющее действие исключительно малых количеств примесей, что трудно объяснить с позиций классической кинетики. Из этого следует, что действительный механизм указанных реакций иной, чем это вытекает из стехиометрических уравнений.
Известно, что многие газовые реакции значительно легче протекают через ряд промежуточных стадий с образованием промежу точных продуктов. Такие реакции характеризуются более низким порядком и меньшей энергией активации по сравнению с реакциями, в которых участвуют молекулы исходных веществ. Развиваясь окольным путем, промежуточные стадии реакции минуют высокий энергетический барьер, который преодолевается реакциями с исходными веществами.
Промежуточными продуктами обычно являются свободные атомы и радикалы, обладающие высокой реакционной способностью по сравнению с валентно насыщенными молекулами и поэтому называемые активными частицами. Свободные радикалы (активная форма вещества) представляют собой осколки молекул или молекулы, находящиеся в электронно-возбужденном состоянии. В пламени различных реакций горения содержатся в значительных концентрациях свободные радикалы, например, ОН, СО, СО2 и атомы О, Н.
При взаимодействии активных частиц с исходными веществами образуются не только конечные продукты реакций, но и новые активные промежуточные продукты, в результате чего обеспечивается непрерывная цепь превращений, т. е. дальнейшее течение реакций. Такие реакции относятся к цепным. Теория реакций, разработанная в основном академиком Н. Н. Семеновым и его сотрудниками, получила мировое признание. Эта теория не отвергает основные законы классической кинетики, а использует их для описания промежуточных элементарных реакций.
При многих химических реакциях выделение значительного количества теплоты сопровождается повышением температуры реагирующих веществ и увеличением скорости их взаимодействия. Процесс будет протекать стационарно в том случае, если отводить выделяющуюся теплоту и поддерживать температуру постоянной. При дальнейшем повышении температуры реагирующих веществ и продуктов реакции наступает тепловой взрыв.
Химические реакции, состоящие из ряда повторяющихся циклов с участием свободных атомов и радикалов называются цепными. Эти реакции характеризуются тремя типами превращений: зарождение, разветвление и обрыв цепей. При зарождении цепи нормальные молекулы распадаются на атомы и радикалы, на что расходуется определенное количество энергии. В связи с этим распад молекул на атомы и радикалы происходит при сообщении системе энергии извне (в виде излучения, энергии химического взаимодей-ствия, электрической энергии и т. д.). После того как радикалы и атомы возникли, реакция развивается самопроизвольно.
Цепные реакции разделяются на неразветвленные и разветвленные. Цепные реакции, в которых в каждом акте развития цепи при гибели одной активной частицы вновь возникает одна активная частица, относятся к неразветвленным или простым цепным реакциям. Примером может служить реакция взаимодействия водорода с хлором, в которой при гибели одного атома хлора, являющегося активной частицей, возникает одна активная частица атома водорода, и наоборот. К разветвленным цепным реакциям относятся такие реакции, при которых на одну гибнущую частицу приходится две или больше вновь возникающих активных частиц. Характерной особенностью разветвленных цепных реакций является наличие предельных параметров, в частности верхнего и нижнего пределов давлений. При давлениях выше верхнего и ниже нижнего пределов разветвленная реакция развиваться не может (рис. 1).
При соответствующих значениях Р и Т имеется область АБВГ, называемая полуостровом воспламенения. В этой области определенной температуре отвечает нижний Р1 (на линии АБ) и верхний Р2 (на линии БВ) пределы воспламенения. Выше величины давления Р2 и ниже Р1 скорость реакции весьма мала. Третий предел воспламенения Р3 на линии ВГ наблюдается при высоких давлениях.
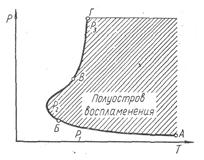
Рис. 1. Зависимость верхнего и нижнего пределов давления от температуры.
Н Н. Семенов с сотрудниками, изучая окисление паров фосфора, окиси углерода и водорода при низких давлениях, установили для этих реакций систему предельных значений различных параметров, разграничивающих области, в которых реакции практически не идут, от областей, в которых они протекают с большимй скоростями. К таким параметрам относятся давление, температура, геометрические размерысосудов, в которых протекает реакция, степень разбавления реагирующей смеси инертными веществамй и др. Было обнаружено также, что весьма интенсивное горение паров фосфора в кислороде полностью прекращается пр'и парциальном давлении кислорода ниже нижнего критического давления воспламенения порядка 6,67 Па. При повышении давления только на 1,33 Па происходит вспышка. Если же давление на 1,33 Па ниже критического, смесь паров фосфора и кислорода может существовать как угодно долго.
Результаты исследований показали, что критическое давление кислорода зависит от упругости паров фосфора, диаметра сосуда, количества инертнога газа. Взаимосвязь между указанными величинами описывается эмпирической формулой
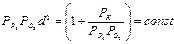
где Рр4 Ро2 и РК — парциальные давления паров фосфора, кислорода и инертного газа; d— диаметр сосуда.
При давлениях ниже критического среднее число актов обрыва цепей больше числа актов их разветвления. В этом случае горение становится невозможным. Когда давление превышает нижнее критическое, вероятность обрыва цепей уменьшается из-за того, что частота столкновения частиц увеличивается, а вероятность достижения активными частицами стенок сосуда уменьшается. При повышении концентрации инертного газа и увеличении диаметра сосуда затрудняется диффузия активных центров к стенке сосуда, что приводит к уменьшению скорости обрыва цепей.
Важная характеристика цепных реакций — так называемый период индукции, характеризует время, в течение которого концентрация активных центров лавинообразно нарастает.
Зависимость периода индукции от давления или концентрации смеси при не слишком больших значениях Р описывается приближенным уравнением Н. С. Акулова
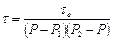 (1)
(1)
где τо — постоянная; Р1 и Р2 — пределы давлений, при которых происходит воспламенение (взрыв).
Из уравнения (1) вытекает, что при Р < Р1 или Р > Р2 величина τ становится отрицательной, а при давлении Р = Р1 и Р = Р2 период индукции равен бесконечности. Результаты экспериментальных исследований показывают, что в ряде случаев наблюдаются не два, а три предела самовоспламенения или взрыва.
2. Реакция горения смесей водорода и кислорода — предмет многочисленных исследований. В пределах граничных давлений Р1 и Р % она является разветвленной цепной реакцией. При давлениях, превышающих верхний предел (Р > Р2), реакция горения водоро-да становится неразветвленной цепной реакцией.
Разветвленная цепная реакция горения водорода состоит из ряда этапов: зарождения цепей
Н2 + О2 → 2(ОН)
продолжения цепей
ОН + Н2 → Н2О + Н
разветвления цепей
Н2 + О2 → ОН + О
О + Н2 → ОН + О
обрыва цепей в объеме
Н2 + О2 + М → Н О2 + М
обрыва цепей на стенках сосуда

При самом незначительном количестве возникших по реакции (1) радикалов возможно лавинообразное развитие процесса и воспламенение водорода. Разветвленная цепная реакция горения водорода имеет вид, показанный на схеме
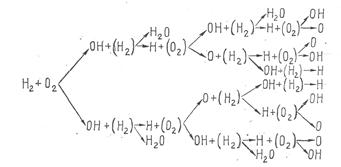
Разветвленная цепная реакция горения водорода.
Когда в системе давление достигает верхнего предела (Р>Р2), реакция горения водорода становится простой неразветвленной цепной реакцией. В таких условиях тройные столкновения частиц преобладают над двойными, при этом элементарные реакции разветвления цепи резко замедляются. Развитие получает реакция Н + О2 + М-+• НО2 + М, при которой путем тройных столкновений расходуются атомы водорода и генерируются радикалы НО2 в тем большей степени, чем выше давление. При давлении, близком к нижнему пределу Р1 (но несколько выше его), скорость реакции практически становится равной нулю, так как вероятность тройных столкновений частиц чрезвычайно мала.
Разветвленная цепная реакция горения водорода развивается в условиях полуострова воспламенения. При давлении Р > Р2 эта реакция из самоускоряющейся переходит в неразветвленную, протекающую по схеме, изображенной на рис.
Реакция горения водорода является одной из тех реакций, экс-периментальные исследования которых позволили получить необходимый фактический материал, положенный в основу теории разветвленных цепных реакций. Установлено, что главные черты механизма горения водорода свойственны реакциям горения других газов, в связи с чем реакцию горения водорода следует рассматривать как модельную.
А. Б. Налбандян и В. В. Воеводский установили зависимость нижнего и верхнего пределов воспламенения водорода от ряда факторов.
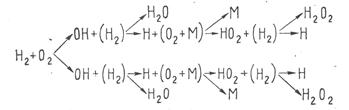
 Неразветвленная цепная реакция горения водорода.
Неразветвленная цепная реакция горения водорода.
Уравнение нижнего предела воспламенения имеет вид: для кинетической области для диффузионной области
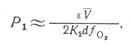 (2)
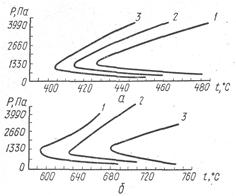
(2)
Рис. 3. Предел самовоспламенения стехиометрических смесей окиси углерода с кислородом при наличии: а — водорода; б —водяных паров (/—5%; 2-2%; 3-1%)
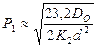
где ε — вероятность рекомбинации атомов водорода при ударе о стенку;  - средняя тепловая скорость активных частиц; d — диаметр сосуда; Dо — коэффициент диффузии атомов кислорода при Р = 1,333 Па; ƒо2 — доля кислорода в смеси, К2 – константа скорости химической реакции образования воды в цепи горения водорода.
- средняя тепловая скорость активных частиц; d — диаметр сосуда; Dо — коэффициент диффузии атомов кислорода при Р = 1,333 Па; ƒо2 — доля кислорода в смеси, К2 – константа скорости химической реакции образования воды в цепи горения водорода.
В работе описаны результаты измерения на вакуумной установке пределов самовоспламенения стехиометрической смеси СО с кислородом без катализирующих добавок, а также емесей с добавками неболыпих количеств водорода или водяных паров (рис.3). Из кривых рисунка следует, что с повышением концентрации катализирующих добавок водяных паров или водорода полуостров воспламенения сдвигается в зону более низких температур. Вместе с тем водород по сравнению с водяным паром оказывает большее катализирующее действие. При этом полуостров воспламенения водородсодержащих смесей сдвинут почти на 200°С в область более низких температур по сравнению с полуостровом воспламенения смесей, имеющих одинаковые концентрации водяных паров.
Высокотемпературный механизм горения СО при наличии водяных паров или водорода впервые был предложен Н.Н. Семеновым и Я.Б. Зельдовичем.
1 → Н + О2 = ОН + О
2 → ОН + СО = СО2 +Н
3 → СО + О = СО2
4 → О + Н2 ↔ Н +ОН (равновесие)
5 → ОН + Н2 ↔ Н2О + Н (равновесие)
Механизм горения метана и дгугих углеводородов более сложен по сравнению с механизмом горения водорода. Реакция конверсии метана двуокисью углерода протекает при температуре выше 900° и со значительным эндотермическим эффектом. В этом процессе образуются монорадикалы метана, метоксила и формина, а также формальдегид. Элементарные функции взаимодействия метана с двуокисью углерода могут быть представлены следующей схемой]:
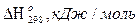
1 → СН4 = СН3 + Н + 432,6;
2 → СН3 + ОСО = СН3О + СО + 152,0;
3 → СН3О = Н2СО + Н + 71,4;
4 → Н2СО = НСО + Н + 323,4;
5 → НСО = Н + СО + 142,8;
6 → 4Н = 2Н2 +стенка - 875,3;
_______________________________
7 → СН4 + СО2 = 2СО + 2Н2 + 246,9.
В приведенной схеме механизма реакций взаимодействия и разложения молекул и радикалов наиболее трудной в энергетическом отношении стадией является процесс разложения метана 1 с образованием метильного радикала СН3 и атомарного водорода, на что расходуется 432,6 кДж/моль. Реакция 4 разложения
формальдегида с образованием радикала формила НСО и атомарного водорода требует затрат тепла 323,4 кДж/моль.
Так как в газовой смеси концентрация атомарного водорода незначительна, условия для протекания реакции 6 отсутствуют. Рекомбинация атомов водорода возможна при тройном соударении двух атомов водорода с инертной молекулой газа или стенкой, которые отводят выделенную энергию. Атомарный водород, возникающий в результате протекания указанных элементарных реакций, взаимодействует с молекулой метана, образуя молекулярный водород и радикал метила. Реакция протекает с небольшим выделением тепла, энергия активации равна 45,5 кДж/моль:
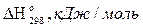
1 → СН4 + Н = СН3 + Н2 – 5,1;
2 → СН3 + ОСО = СН3О + СО + 15,0;
3 → СН3О = Н2СО + Н + 71,4;
4 → Н2СО + Н = НСО + Н2 – 114,2;
5 → НСО = Н + СО + 142,8;
_____________________________________
СН4 + СО2 = 2СО + 2Н2 + 246,9.
При взаимодействии метана с двуокисью углерода возможны и другие промежуточные реакции, однако они не могут получить развития, так как для этого потребуется значительное количество тепла. Взаимодействие метана с парами воды также протекает по цепному механизму.
Окись углерода в условиях низких температур термодинамически неустойчива и должна распадаться на двуокись углерода и твердый углерод. Однако эта реакция сильно заторможена, так как при низких температурах нестабильное состояние окиси углерода весьма устойчиво. Заметный распад окиси углерода при низких температурах возможен в присутствии катализаторов. Наиболее активными катализаторами этой реакции являются металлическое железо (в особенности восстановленное при низких температурах), затем кобальт, никель. К металлам, катализирующим распад окиси углерода, относятся также хром и, повидимому, марганец, алюминий, титан.
Продолжительное время оставалось не установленным, что служит катализатором распада реакции окиси углерода: металлическое железо или его окислы. Для решения этой задачи необходимо было создать условия, когда при наличии окиси углерода в газовой фазе не происходило бы восстановления железа из его окислов. Г. И. Чуфаров и А. Н. Куликов длительное время пропускали смесь, состоящую из 50% окиси углерода и 50% углекислого газа, через закись железа при 600—625°С. В этом случае не наблюдалось распада окиси углерода. Последнее свидетельствует о том, что закись железа не может быть катализатором распада окиси углерода. Подобного рода опыты были проведены с магнитной окисью железа. Оказалось, что магнитная окись, также как и закись железа, не влияет на скорость распада окиси углерода.
Реакция 2СО = СО2 + С играет существенную роль в металлургических процессах, так как она оказывает влияние на скорость восстановления железных руд и агломератов в доменном процессе, а также на срок службы футеровки доменных печей. Сажистый углерод, образующийся при распаде окиси углерода, накапливаясь в порах железных руд и агломератов, способствует их растрескиванию, увеличению поверхности контакта с газовой фазой и ускорению восстановительных процессов.
Кладка доменных печей выполняется из шамотного кирпича, содержащего небольшое количество окислов железа. Внутри кладки доменных печей при температурах 400—700°С создаются условия для распада окиси углерода (доменный газ проникает в толщу кладки и постепенно восстанавливает окислы железа). Образующиеся частицы восстановленного железа являются катализатором распада окиси углерода. В результате указанной реакции в порах шамотного кирпича накапливается сажистый углерод, возникают напряжения, приводящие к растрескиванию и разрушению шамотного кирпича. Возможны также разрывы стальной брони кожуха доменных печей.
По действующим стандартам содержание окислов железа в шамотном кирпиче не должно превышать 1,5%. Для предотвращения выделения сажистого углерода в шамотной кладке доменных печей шамот обжигают в условиях высоких температур, при которых окислы железа взаимодействуют с SіО2 и становятся трудновосстановимыми. Если обжиг шамота произвести в восстановительной атмосфере при вьгсокой температуре, полученное железо не будет обладать свойствами активного катализатора.
3 Взаимодействие твердого углерода с газообразным кислородом возможно при непрерывном подводе его к фронту реакции. Процесс будет развиваться в кинетичесиой или диффузионной области в зависимости от соотношения скоростей химического и диффузионного звеньев.
При низких температурах, когда константа скорости химического звена К мала по сравнению с коэффициентом диффузии D реализуется кинетический тип процесса, взаимодействие кислорода с углеродом протекает с малой скоростью и в единицу времени выделяется недостаточное количество тепла. В случае равенства прихода тепла и отвода его в окружающее пространство устанавливается постоянная температура и тепловой саморазгон невозможен, поэтому такое течение реакции называется окислением в противоположность процессу горения.
Если повышать температуру воздуха, омывающего куски топлива, скорость химической реакции при определенных значениях К изменяется быстрее, чем величина D. Процесс скачкообразно переходит из кинетической в диффузионную область и происходит воспламенение. Обычно воспламенение углей наблюдается в интервале температур 700—800°С.
На развитие процесса окисления или горения твердого углерода определенное влияние оказывает характер движения окисляющего газа (кислорода, воздуха). При ламинарном движении в макропотоках кислорода воздуха отсутствуют составляющие скорости,перпендикулярные к границе раздела фаз. Турбулентное движение окисляющего газа характерно тем, что скорость потоков не остается постоянной по величине и направлению Составляющие скорости, направленные перпендикулярно к поверхности твердого углерода, способетвуют внутренней диффузии газа окислителя в поры и трещины углерода.
Количество выделяемого тепла определяется скоростью процесса горения. Оно по разному изменяется под влиянием температуры и условий реагирования. В кинетической области скорость взаимодействия углерода с кислородом, а также количество выделяемого тепла ΔΗК возрастают с повышением температуры по экспоненциальному закону:
∆Нk= Ae-E/RT (1)
В диффузионной области скорость реакции зависит от температуры и величины коэффициента диффузии. Это обусловливает слабую зависимость скорости реакции и пропорциональной ей величин ∆НD:
∆НD= ВVkTn (2)
где V — скорость воздушного потока; n = 1,5÷2, величина k в два раза меньше значения n.
Сравнительно «низким температурам» воздуха, омывающего кусок топлива, отвечают стационарные режимы, величины ∆Нk и ∆НD уравновешиваются. При этом температура поверхности куска топлива увеличивается незначительно.
Когда температура воздуха достигает некоторого критического значения Tкр наступает тепловое равновесие ∆Нk = ∆НD. При переходе температуры через критическое значение происходит нарушение теплового равновесия. При дальнейшем повышении температуры воздуха в системе становится невозможным восстановление нарушенного теплового равновесия. В интервале температур, в котором сохраняется неравенство ∆Нk>∆НD и происходит тепловой саморазгон процесса.
При высокой температуре реакция взаимодействия углерода с кислородом приобретает особенности, характерные для процесса горения. Температура, при которой окисление скачкообразно заменяется горением, называется температурой воспламенения.
Таким образом, воспламенение твердого углерода происходит при нагревании его до температур, выше которых скорость поступления тепла в результате химической реакции превышает скорость его отвода, что приводит к саморазогреву и переходу процесса в устойчивое высокотемпературное горение. Температура воспламенения может быть определена как температура, выше которой происходит скачкообразный переход от окисления к горению, от ки-нетического режима к диффузионному.
Факторы, повышающие скорость химического превращения (обогащение дутья кислородом, повышение активности и величины реакционной поверхности углерода), ускоряют воспламенение. Так, древесный уголь воспламеняется при более низкой температуре, чем каменноугольный кокс. Это обусловлено тем, что в древесном угле значительно большая удельная поверхность пор и выше адсорбционно химическая активность углерода.
С повышением температуры воздуха за пределами точки воспламенения возникает ряд стационарных режимов, которые связаны с ростом температуры поверхности горящего куска топлива.
Если понижать температуру воздуха, омывающего кусок интенсивно горящего топлива, то переход от горения к окислению просходит скачкообразно. Дальнейшее понижение температуры воздуха связано с тем, что количество выделяемого тепла становится недостаточным, чтобы компенсировать потери тепла в окружающую среду, в результате чего поверхность куска топлива начинает охлаждаться. В указанных условиях происходит тушение топлива, процесс смещается из диффузионной в кинетическую область, от горения — к окислению.
§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
Взаимодействие углерода с СО2 усиливается с повышением температуры: при 1300°С оно завершается через 2—З сек, тогда как при 900°С процесс не заканчивается и через 80 сек. Установлено, что наиболее реакционноспособным является древесный уголь, значительно медленнее реагирует с С02 антрацит. Кокс занимает промежуточное положение.
Взаимодействие углерода с его двуокисью, как и взаимодействие углерода с кислородом, связано с адсорбцией реагирующего газа углеродом.
При температурах 400°Си выше развиваеься химическая адсорбция, связанная с поглощением активными поверхностными атомами углерода молекул СО2. Дальнейшее повышение температуры характеризовается тем, что во взаимодействие вовлекалось увеличивающееся количество поверхностных атомов углерода, силовое поле которых приводило к растягиванию молекул СО2 и отрыву от них по одному атому кислорода. Такие процессы завершались образованием двух поверхностных соединений, названных кетенными комплексами:
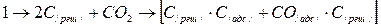
Когда температура достигала 500—600°С, кетенные комплексы становились неустойчивыми и начинают распадаться с выделением молекул СО:

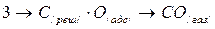
Повышение температур способствует увеличению количества распадающихся кетенных комплексов.
Процесс образования и разрушение кетенных комплексов развивается постепенно. С ростом температуры во взаимодействии участвует большее число комплексных соединений. Это приводит к разрушению кристаллической решетки, в результате чего новые атомы углерода начинают участвовать в образовании поверхностных комплексов.
Взаимодействие углерода с СО2 в зависимости от тормозящего звена может развиваться в диффузионной, промежуточной или кинетической областях. Для указанного процесса характерно перемещение реакционной зоны с поверхности в объем углеродистого материала, что связано с его пористостью и дополнительным разрыхлением поверхности.
Механизм реакции взаимодействия углерода с водяным паром изучен менее подробно, чем взаимодействие СО2 с твердым углеродом. Вместе с тем ряд экспериментальных данных указывает на аналогию между этими двумя процессами. Проведенными исследованиями в условиях вакуума установлено, что в результате взаимодействия водяного пара с углеродом в эквимолекулярных количествах образуются только СО и Н2. Таким образом, первичное взаимодействие углерода с водяным паром, когда продукты взаимодействия не вступают в последующую вторичную реакцию с углеродом, можно представить суммарным стехиометрическим уравнением
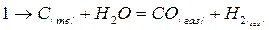
Реакция газификации углерода водяным паром развивается как реакция нулевого порядка. Подтверждением этому является независимость скорости процесса от давления водяных паров.
Механизм взаимодействия С + Н2О сходен с принятым для реакции С + СО2. На поверхности углерода молекулы водяного пара распадаются, образуя кетокомплексы и адсорбированные атомы водорода:
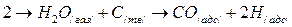
При дальнейшем ходе реакции кетокомплексы распадаются с выделением газообразной окиси углерода. Взаимодействие СО2 в зависимости от тормозящей стадии может развиваться как в диффузионной так и кинетической области. В диффузионной области скорость процесса характеризуется скоростью конвективной диффузии и может быть рассчитана по уравнению;
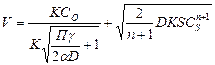 (1)
(1)
где: К – константа скорости химической рекций, D – коэффициент диффузии, α – коэффициент скорости потока, n – порядок реакции, S – реакционная поверхность, СS – концентрация газа на поверхности, γ – размер частиц углеродистого материала. В кинетической области при минимальной скорости самой химической реакции скорость процесса определяется кинетическим уравнением:
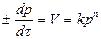 (2)
(2)
Влияние температуры в зависимости от температурной области описывается правилами Вант-Гоффа и Аррениуса.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1744; Нарушение авторских прав?; Мы поможем в написании вашей работы!