
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Т а б л и ц а 1. Константы диссоциации и парциальные давления компонентов при диссоциации глинозема
|
|
|
|
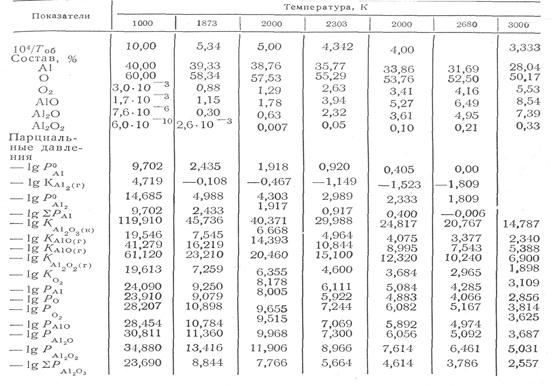
При диссоциации суммарное давление паровой фазы имеет минимальное значение (1,4-10-7 кПа), давление атомарного кислорода составляет 8,3-10-8 кПа, а молекулярного кислорода—1,25-10-9 кПа". В продуктах диссоциации основ-ными компонентами являются одноатомный кислород, алюминий и его пар, молекулярные компоненты АlO, А12О и А120з. Для температуры 1873 К содержание трех последних компонентов не превышает 2,5%, а при 3000 K — увеличивается до 20%. Из приведенных данных следует, что теория диссоциации химических соединений, разрабатываемая И. С. Қуликовым, более полно охватывает многообразие процессов диссоциации.
В металлургических процессах важную роль играют химические реакции, связанные с различными превращени-ями окислов, прочность которых определяется сродством соответствующих элементов к кислороду. Для того чтобы осуществить термическую диссоциацию таких окислов, как ҒеО, МпО, Sі02, при температурах 1500—1600° С, необходимо понизить давление кисло-рода до очень малых значений или повысить температуру до значитель-ных величин. Последнее невозможно осуществить в обычных металлургических агрегатах.
Чтобы получить для - FеО, МпО и SіО2 давление кислорода, равное 21,3 кПа, необходимо нагреть их соответственно до 3500, 4000 и 5000° С.
На величину 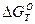 реакций образования окислов оказывают влияние фазовые переходы и особенно переходы Ме и МеО в газообразное состояние.
реакций образования окислов оказывают влияние фазовые переходы и особенно переходы Ме и МеО в газообразное состояние.
Химические взаимодействия протекают как между твердыми веществами, так и между веществами, находящимися в растворах. Активности конденсированных веществ в ненасыщенных растворах зависят от концентрации веществ и не равны единице. Тогда упругость диссоциации окислов в ненасыщенных растворах можно определять, пользуясь формулой
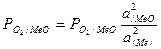 (15)
(15)
где Ро2/МеО/ и Ро2/МеО/ — соответственно упругость диссоциации окисла в растворе и в конденсированном состоянии; а и а/Ме/ — активности окисла и металла в ненасыщенных растворах.
Активности компонентов в растворах связаны с концентрациями соотношением
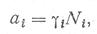 (16)
(16)
где γi — коэффициент активности; Ні — концентрация, выраженная в мольных долях. С учетом соотношения (16) уравнение (17) записывается так:
 (17)
(17)
Из уравнения (17) следует, что с уменьшением в растворе концентрации диссоциирующего окисла МеО упругость диссоциации последнего снижается, а прочность возрастает. Когда уменьшается концентрация окисляющегося вещества, повышается упругость диссоциации окисла, что связано с понижением сродства металла к кислороду.
§ 4. Известны три окисла железа, устойчивые при повышенных температурах:
Fe2O3 – окись железа – гематит, существует в 2х модификациях α и γ
Fe3O4 – магнитная окись железа магнетит, плавится при 1597 оС, имеет
постоянный состав до 1100 оС, выше состав переменный с большим
содержанием кислорода, чем по формуле Fe3O4.
FeO – закись железа вюстит, устойчиво при температурах выше 570 оС.
При наличии в системе нескольких соединений одного и того же металла превращения осуществляются в определенной последовательности. В обширной работе, обобщающей закономерности реакций диссоциации и восстановления окислов, А. А. Байков установил принцип реагирования таких систем.
«Химические превращения совершаются последовательно, скачками, проходя через все те химические соединения, которые могут существовать в данной системе».
Для окислов железа выявлены две возможные схемы превращений. Одна из них предусматривает последовательную диссоциацию от высшего окисла к низшему с отщеплением кислорода:
Fe2O3 → Fe3O4 → FeO → Fe.
Таким реакциям диссоциации содействуют более высокие температуры. По второй схеме превращение осуществляется с отщеплением железа при переходе от низшего окисла к высшему:
FeO → Fe3O4 → Fe2O3 → O
Этому содействуют пониженные температуры. Такие общие закономерности в настоящее время нетрудно обосновать, опираясь на термодинамические данные для различных окислов. Их взаимный переход с отщеплением кислорода по высокотемпературной схеме возможен по обратным реакциям диссоциации:
1 → 6Fe2O3 ↔ 4Fe3O4+O2 ∆H = 458,870 кДж
= 458,870 кДж
2 → 2Fe3O4 ↔ 6FeO+O2 ∆H = 639,740 кДж
= 639,740 кДж
3 → 2FeO ↔ 2Fe+O2 ∆H = 534,230 кДж
= 534,230 кДж
Вероятность реакций и прочность окислов можно оценить по величинам ∆G○ реакции образования. Их температурные функции, построенные по имеющимся данным, выражаются отрезками прямых, расположенных под различным углом к оси температур (рис. 1).
 ∆G○
∆G○
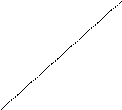 1 - Fe2O3
1 - Fe2O3
Рис. 1. Температурная зависимость ∆G○
2 - Fe3O4 образования окислов железа.
 3 - FeO
3 - FeO
 4 - Fe3O4
4 - Fe3O4
 |

843○ K T
Последнее обстоятельство вызывает пересечение кривых и различное их сочетание выше и ниже температуры примерно 570○С.
Для температур выше 570○С кривая для первой реакции (образования Fe2O3 из Fe3O4) расположена в верхней части диаграммного поля. Это свидетельствует об относительно малой убыли изобарного потенциала при образовании Fe2O3, об относительно высоком кислородном потенциале этого окисла, малой прочности и сравнительно легкой его диссоциации. Ниже по порядку убыли ∆G○ и возрастанию прочности окисла располагается кривая для Fe3O4, образованной из FeO. Однако возможно конкурирующая с ней реакция образования Fe3O4 из Fe и O2 с более значительной убылью ∆G○:
4 →  Fe3O4 ↔
Fe3O4 ↔ 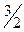 Fe + O2 ∆H
Fe + O2 ∆H = 560,600 кДж
= 560,600 кДж
Чтобы оценить вероятность такого превращения, следует сравнить реакцию 4 с реакцией 3, в которой также участвуют Fe и O2, но с образованием FeO. При таком сравнении легко убедиться, что реагирование железа с кислородом полнее завершается с образованием более прочной FeO, чем Fe3O4. Это исключает стадию превращений по реакции 4 и при диссоциации Fe3O4 в высокотемпературной области возможен переход только в FeO.
Для температур ниже 570○С остается кривая образования Fe2O3 и соответствующая ей реакция 1. Ниже располагается отрезок кривой ∆G○ образования FeO из Fe и О2. Однако еще ниже находится кривая для конкурирующей реакции 4, по которой также реагируют Fe и О2, но с образованием Fe3O4 . Более значительная убыль ∆G○ при образовании Fe3O4 и более высокая ее прочность по сравнению с FeO исключает возможность существования FeO и реакции с ее участием. По этой же причине становится невероятной реакция 2 образования Fe3O4 из FeO.
Таким образом, в низкотемпературной области закись железа становится термодинамически неустойчивой и превращается в Fe3O4:
4 FeO ↔ Fe3O4 + Fe.
§ 5. Реакция выражает диссоциацию низшего окисла с отщеплением металла и отвечает низкотемпературной схеме превращений окислов А.А. Байкова. При температуре около 570○С в точке пересечения кривых достигается равновесное существование двух окислов железа Fe3O4 и FeO с металлическим железом и газообразным кислородом. Система из четырех фаз и двух компонентов оказывается нонвариантной:
С = К + 2 – Ф = 2 + 2 – 4 = 0
Отвод тепла при понижении температуры вызывает полное превращение FeO.
В связи с неустойчивостью FeO становится возможной новая реакция образования диссоциации Fe3O4 непосредственно из Fe и О2:
Термодинамические данные для этой реакции оказываются средними величинами из данных для реакции 2 и 3:
∆H4 = 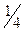 (∆H2 + 3∆H3),
(∆H2 + 3∆H3),
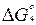 =
= 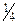 (
( ).
).
Такая взаимосвязь термодинамических характеристик имеет общее значение и позволяет предвидеть сочетание реакций взаимодействия высшего и низшего окисла и наличие температуры образования и устойчивости последнего. Термодинамический анализ возможных реакций в системе Fe – O показывает, что каждый окисел имеет собственную величину ∆G○ образования и соответствующие ей характеристики прочности. Последовательное и скачкообразное уменьшение величин ∆G○ и возрастания прочности кислородных соединений металла предопределяет последовательное превращение высших окислов и низшие, вплоть до отделения металла. При температурах выше 570○С превращения окислов проходят через все возможные ступени, согласно последовательному изменению их свойств:
I II III

 Fe2O3
Fe2O3
 Fe3O4 FeO
Fe3O4 FeO



 О2 О2 О2
О2 О2 О2
 Fe3O4 FeO Fe
Fe3O4 FeO Fe
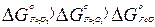 ;
;
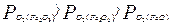 .
.
При температурах ниже 570○С возникает другая последовательность прочности окислов и появляется новая ступень превращений IV, исключающая реагирование FeO. Вслед за разложением окиси железа диссоциирует магнитная окись железа с выделением железа, минуя образования закиси железа:
1 → 6Fe2O3↔4 Fe3O4+ О2+∆H1;
2 →  Fe3O4↔
Fe3O4↔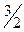 Fe+ О2+∆H4.
Fe+ О2+∆H4.
Все реакции диссоциации с выделением кислорода осуществляются с поглощением тепла и возрастанием  системы:
системы:
∆H1=458870 дж/моль О2
∆H2=639740 >>
∆H3=534230 >>
∆H4=560600 >>
По принципу смещений равновесия любая из них завершается полнее при повышении температуры.
В количественной форме различные термодинамические свойства окислов проявляются в величине константы равновесия реакции. Она имеет одно и то же выражение:
Кр = 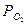
и численно равна упругости диссоциации соответствующего окисла, так как все реакции отнесены к молю реагирующего кислорода.
Таблица 1.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1109; Нарушение авторских прав?; Мы поможем в написании вашей работы!