
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Блиц – тест
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Литература:
41. Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
42. Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
43. Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
44. Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
Лекции №8 «Науглероживание железа оксидом углерода»
План лекции:
1.Термодинамические условия протекания реакций и образования соединений.
2.Механизм и кинетика взаимодействия в системе Ме-С-О.
3.Науглероживание железа метаном.
4.Термодинамические условия взаимодействия оксидов с СH4.
5.Механизм и кинетика протекания реакций.
Цель лекции:
Ознакомление с понятием науглероживание углерода
Дидактические единицы:
Карбонизация; спокойная сталь; кипящая сталь; легированная сталь; переплавные процессы;
дефосфорация; рафинирование металлов
1. В процессах восстановления превращения сопровождаются последовательным удалением кислорода из данного окисла и выделением металла. Такие восстановительные процессы имеют большое практическое значение для металлургического производства. Их совокупность составляет основу восстановительной плавки, при которой выплавляются металлы и сплавы различного состава. Во многих системах, где реагируют окисные фазы, приходится встречаться с восстановительно-окислительными процессами.
Из теории диссоциации окислов легко выявляются общие условиях их разложения с выделением металла. Для этого необходимо, чтобы кислородный потенциал системы был ниже кислородного потенциала восстанавливаемого окисла:
πо газ < πо МеО
Это равноценно превышению упругости диссоциации окисла над давлением кислорода в газовой фазе:
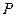

Такие условия практически нереализуемы физическим способом, путем вакуумирования системы. Для многих окислов, имеющих техническое значение, доступные разряжения значительно выше упругости диссоциации. Эффективным оказался химический способ связывания кислорода веществами-восстановителями, обладающими более высоким химическим сродством к кислороду, чем металл восстанавливаемого окисла. Такие свойства веществ и их способность обеспечить условия восстановления можно оценить по величинам ΔGо образования окислов и относительного положения кривых температурных функций ΔGо = f (Т). Применительно к практике интерес представляет газообразные восстановители СО, Н2 и многокомпонентные природные газовые смеси, а также твердые углерод и некоторые неметаллы. При электролизе растворов и расплавов восстановление металла осуществляется на основе электрохимических процессов, не требующих применения специального восстановителя.
При термодинамическом рассмотрении восстановительного процесса его можно представить совокупностью двух обратимых реакций: взаимодействия металла и газообразного восстановителя (например, СО) с кислородом:
1→ 2МеО = 2Ме + О2 - ΔG
2 → 2СО2 = 2СО + О2 - ΔG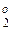
3 → МеО + СО = Ме + СО2 - ΔG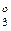
Каждая из реакций в соответствии с химическим сродством реагирующих веществ, выраженных в величинах ΔG1 и ΔG2. В то же время они совершаются в одной системе, взаимно действуя одна на другую. Завершенность реакций характеризуется равновесном составом газовой фазы:
 ;
;
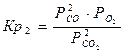
Направление превращений и суммарный результат определяются соотношением величин (ΔG1) и (ΔG2). Опираясь на принцип аддитивности функций состояния, получаем в результате алгебраического суммирования реакций:
ΔG =
=  (1)
(1)
Помимо физико-химической природы реагирующих веществ, на величину ΔG оказывает влияние исходный состав системы, если условие отличаются от стандартных. Необходимо установить предельные состояние системы, содержащие газообразные компоненты СО, СО2 и вещества в конденсированных фазах Ме и МеО, а также возможные изменения составов между этими пределами. В такой сложной системе начальные условие задаются исходным соотношением СО/СО2 и присущим ему парциальным давлением равновесного кислорода. Конечное состояние диктуется кислородным потенциалом окисла или его упругостью диссоциации, неизменной величиной при постоянной температуре, если реагирует чистые фазы без образования растворов. Такое взаимное влияния частных реакций можно отразить в полных выражениях ΔG°:
ΔG =RT(ln РО2 ин – ln РО2); (2)
=RT(ln РО2 ин – ln РО2); (2)
ΔG = RT(ln(Р²СОин· РО2 ин / Р²СО2 ин) – ln(Р²СО· РО2/ Р²СО2)) (3)
= RT(ln(Р²СОин· РО2 ин / Р²СО2 ин) – ln(Р²СО· РО2/ Р²СО2)) (3)
где
Р²СО/ин, РО2/ин, Р²СО2/ин – парциальные давления газообразных компонентов исходной неравновесной системы; Р²СО, РО2, Р²СО2 – парциальные давления в конечной равновесной системе.
Подставляя соотношения ΔG и ΔG
и ΔG в уравнение (1), получаем:
в уравнение (1), получаем:
ΔG =
=  = RT(ln РСО/ РСО2 – ln РСО/ин / РСО2/ин) (4)
= RT(ln РСО/ РСО2 – ln РСО/ин / РСО2/ин) (4)
Общее уравнение (4) выражает термодинамику процесса восстановления окисла или окисления металла газообразным реагентом. Анализ уравнения позволяет выяснить факторы, определяющие направление превращений и конечный результат. Величина и знак ΔG° процесса задается природой реагирующих окислов и составом газовой фазы в начальном неравновесном РСО/РСО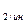 и конечном равновесном состоянии РСО/РСО2/р. Между соотношением РСО/РСО2 и давлением кислорода РО2 имеется эквивалентное соотношение, вытекающие из выражения Кр2:
и конечном равновесном состоянии РСО/РСО2/р. Между соотношением РСО/РСО2 и давлением кислорода РО2 имеется эквивалентное соотношение, вытекающие из выражения Кр2:
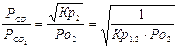 (5)
(5)
Учитывая сказанное, отмечаем условия реагирования рассматриваемой системы:
1. Восстановления окисла ΔG°<0:
ΔG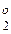 > ΔG
> ΔG ;
;
 (6)
(6)
РО2/г. < РО2/МеО
2. Окисления металла ΔG° > 0:
ΔG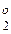 < ΔG
< ΔG ;
;
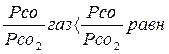 (7)
(7)
РО2/г. > РО2/МеО
3. Равновесие процесса ΔG = 0:
ΔG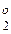 = ΔG
= ΔG ;
;
 (8)
(8)
РО2/г. = РО2/МеО
Опираясь на уравнение (4) и его следствие, нетрудно предвидеть ход превращений для определенных заданных условий. В изолированной системе реакции развиваются от различного исходного состояния до неизменного при постоянной температуре равновесного состояния в направление более низкого кислородного потенциала:
pО МеО ®pО газ
или pО газ ®pО МеО
Восстановление окисла сопровождается затратой восстановителя и обогащением газовой фазы СО2. При этом возрастает парциальное давление свободного кислорода. Все подобное изменения совершаются, пока не будет достигнуто давление кислорода в системе, равное упругости диссоциации окисла, и соответствующие ему равновесное соотношение СО/ СО2. Таким образом, выявляется регулирующая роль природы окисла, которую в краткой форме выражают схемой равновесия:
СО СО2
 |  |
О2
 |  |
Ме МеО
Непрерывное осуществление процесса требует поддержания в системе неравенства в составах газовой фазы, предполагаемого условиями восстановления (6).
Важным следствием общего уравнения (4) является равноценность термодинамического анализа процесса восстановления на основе ΔG и ΔG
и ΔG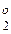 частных реакций, сопоставления составов газовой фазы или давлений кислорода газовой фазы и упругости диссоциации окисла. С наибольшей полнотой и наглядность выявляется закономерности процесса при сравнении давлений кислорода газовой фазы и упругостями диссоциации окислов. В газовой фазе, содержащей СО и СО2
частных реакций, сопоставления составов газовой фазы или давлений кислорода газовой фазы и упругости диссоциации окисла. С наибольшей полнотой и наглядность выявляется закономерности процесса при сравнении давлений кислорода газовой фазы и упругостями диссоциации окислов. В газовой фазе, содержащей СО и СО2
Верхний предел возможных давлении кислорода задается диссоциации СО2 при различных температурах. Нижний предел определяется давлениями кислорода для газовых смесей с различном соотношением СО/ СО2.
На фоне этого поля располагаются четыре типовые кривые упругости диссоциации окислов различной прочности: Ме¹О, Ме²О, Ме³О, Ме⁴О. из относительного положения этих кривых легко судить о вероятности условия
РО2 (СО,СО2) < РО2(МеО);
И эффективности или полноте восстановительного процесса
ΔРО2= РО2- РО2 Н (9)
Возможности восстановления все более ограничивается при переходе от менее прочного окисла Ме¹О к более прочному Ме⁴О в связи с необходимостью понижения кислородного потенциала газовой фазы и увеличения в ней содержания восстановителя СО. Для окислов типа Ме³О и Ме⁴О выявляется такие требования, при невозможно на широком температурном интервале реализовать условия восстановления даже при наличии исходной газовой фазы из чистой СО. Такие окислы нельзя восстановить обычном путем, по крайне мере до температуры, при которой пересекаются кривые упругости диссоциации окисла (например, Ме³О) и нижнего предела давлений кислорода диссоциирующей СО.
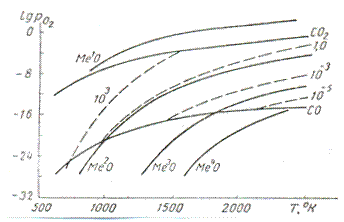
Рис.1. Окислительно-восстановительные свойства газовой фазы в зависимости от состава и температуры.
1 Окислы Ме¹О. К этому типу относится Fe2O3 и в определенной мере Cu2O, CoO, NiO с промежуточным положением кривых между Ме¹О и Ме²О. Окислы типа Ме¹О
характеризуются малой прочностью и легкой восстановимостью. Для выделения металла из окисла может служить даже газовая фаза, получаемая в результате диссоциации СО2.
2. Окислы. Ме²О
Сюда относят Fe3O4, FeO и ZnO. Промежуточное положение занимает Cr2O3. Эти окислы обладает повышенной прочностью; восстановление их возможно при наличии в газовой фазе значительного количества СО.
3. Окислы Ме³О.
Примером являются трудновосстановимые окислы MnO и SiO2 с высоким сродством металла к кислороду. Необходимы высокие температуры и поддержание в системе высоких концентраций СО, чтобы обеспечить развитие восстановительных процессов.
4. Окислы Ме⁴О.
К ним относится очень прочные соединения Al2O3 и MgO, не доступные восстановлению при помощи СО.
Аналогичным образом нетрудно судить о восстановимости других окислов, определяя относительные положения кривых упругости диссоциации или сравнивая кислородные потенциалы. Развитие противоположных процессов окисления металлов и образования различных окислов определяется возможностью условия
РО2 (СО,СО2) > РО2(МеО);
и эффективностью или полнотой превращений
ΔРО2= РО2(Н)–РО2 (10)
Окислительный процесс затрудняется при переходе от Ме⁴О к Ме¹ в связи с необходимым возрастанием окислительного потенциала газовой фазы. Химическое сродство Ме⁴ к кислороду столь велико, что последний полностью заимствуется у СО с выделением углерода. Напротив, СО2 не обеспечивает необходимый окислительный потенциал для образования Ме¹О, и реакция восстановления этого окисла оказывается необратимой в атмосфере СО и СО2. Осуществление равновесия реакции становится возможным со стороны разложения окисла.
2. Закономерности диссоциации-образования соединений вскрывают строгую последовательность изменения термодинамических характеристик прочности различных окислов одного и того же металла. В соответствие с этим осуществляется последовательное восстановление окислов железа от высшего к низшему и металлу по схеме А.А.Байкова. При температурах выше 570°С в превращениях поочередно участвует все окислы железа:
1. 3 Fe2O3 +CO® Fe3O4+ СО2 – ΔH1; (1)
2. Fe3O4+CO®3FeO + СО2 + ΔH2; (2)
3. FeO+CO®Fe++ СО2 – ΔH3; (3)
При температурах ниже 570°С ступени превращений 2 и 3 и соответствующие им реакции заменяются на непосредственно восстановление магнитной окиси
железа до железа по реакции
4.  Fe3O4 + CO =
Fe3O4 + CO =  Fe+ СО2 – ΔH4; (4)
Fe+ СО2 – ΔH4; (4)
Такая схема восстановительных процессов является выражением термодинамических свойств окислов и находится в полном согласии с диаграммой состояния Fe-О.
Из диаграммы следует возможность последовательного превращения твердых фаз, по составу близких к указанным окислам.
Все реакции, за исключением первой, обратимы и развиваются при известных условиях в прямом и обратном направлении. Обратимость реакции (1) затруднена тем, что выделяющийся кислород при диссоциации СО2 не может обеспечить в системе превышение кислородного потенциала Fe2O3. Однако равновесное состояние реализуется со стороны диссоциации Fe2O3. С точки зрения принципа смещения равновесий давление не должно оказывать влияния ввиду неизменности числа реагирующих газообразных частиц. Влияния температуры на смещения равновесия реакции согласуется со знаком и величиной теплового эффекта. Последний легко предвидеть на основе известных величин изменение энтальпии реакции образования – диссоциации соответствующих окислов:
ΔH=0,5(ΔH/1,2– ΔH/МеО) (5)
Тепловые эффекты реакций восстановления окислов железа имеют следующие значения:
ΔH1=-53740 Дж (-12835 кал).
ΔH2=36680 Дж (8760 кал).
ΔH3=-16060 Дж (-3865 кал).
ΔH4=-2870 Дж (-685 кал).
Как показывает знаки тепловых эффектов, более полному завершению восстановление магнитной закиси железа содействует повышение температуры, тогда как для других реакций- ее понижение. Равновесное состояние системы из трех фаз и трех компонентов характеризуется двумя степенями свободы:
С = К + 2 – Ф = 3 - 3 +2 = 2
Конечный результат каждый из реакций должен определяться двумя переменными величинами, например, парциально давления водорода газовой фазы следует представить зависимости от температуры и общего давления:
р Н2=¦(Т, р).
Однако общее давление, как отмечено выше, не изменяет равновесного состояния, но задает величину парциальных давлений газообразных компонентов:
р Н2+ р Н2О= р
Роль температурного фактора в явной форме выявляется из температурной функции константы равновесия. Ее выражение остается общим для всех реакций, но изменяется числовое значение:
Кр= РСО2/ РСО (6)
Состав равновесной газовой фазы тесно связан с кислородным потенциалом, который в данным случае определяется природой окисла. Чем выше прочность окисла и ниже ΔG°МеО и кислородный потенциал, тем ниже соотношение РСО2/РСО в равновесной газовой фазе. Поэтому числовое значение константы равновесия реакции восстановления скачкообразно понижается при переходе от высших окислов к низшим.
Fe2O3® Fe3O4® FeO® Fe.
Количественные данные равновесии реакций восстановления окислов железа неоднократно определяли опытным путем и расчетным путем. Усредненные данные для твердых реагирующих фаз можно представить температурными функциями ΔG° или Кр реакций восстановления, сохраняя принятую для них нумерацию.
Для 1 реакции:
ΔG = - 5213 – 41,0 Т (7)
= - 5213 – 41,0 Т (7)
lg Кр/1 =  (8)
(8)
Для 2 реакции:
ΔG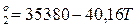 (9)
(9)
lg Кр/2 =  (10)
(10)
Для 3 реакции:
ΔG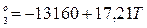 (11)
(11)
lg Кр/3 =  (12)
(12)
Для 4 реакции приближенно:
ΔG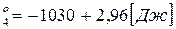 (13)
(13)
lg Кр/4 =  (14)
(14)
Расчетные данные получают, комбинируя реакции диссоциации соответствующих окислов взаимодействия восстановителя с кислородом. При этом можно вести поправки на фазовые переходы или образование растворов.
На рис. 2 представлены кривые равновесии окислов железа с СО- СО2 газовой фазы.
Диаграмма в таком изображении является отраженным пространственного графика равновесие в системе СО- СО2-О2. Она демонстрирует пример термодинамического анализа реакций восстановления на основе сопоставления составов газовой фазы. Согласно уравнению (5), равновесные кривые смещаются к пограничной оси 100%-ного содержания СО при переходе от высшего окисла к низшему. Прочность высшего окисла Fe2O3 столь низка, что в равновесной газовой фазе содержатся незначительные количества СО. Равновесная кривая для реакции 1 условна отмечена пунктиром вблизи оси 100%-ного содержания СО2.
 Рис.2. Диаграмма равновесии окислов железа с газовой фазой из СО и СО₂
Рис.2. Диаграмма равновесии окислов железа с газовой фазой из СО и СО₂
Положение кривых относительно температурной оси связано со знаком и величиной теплового эффекта реакции -ΔН:
 (15)
(15)
Положительному значению теплового эффекта соответствует уменьшение величине РСО2/РСО с ростом температуре.
Каждая из кривых показывает изменение состава газовой фазы с изменением
температуры, находящейся в равновесии с двумя конденсированными фазами, участвующими в соответствующих реакциях. Кривая 1 отвечает Fe2O3- Fe3O4-СО- СО2, кривая 2- Fe3O4- FeO- СО- СО2, кривая 3- FeO-Fe- СО- СО2, кривая 4- Fe3O4- Fe- СО- СО2. Примыкающие к равновесным кривым диаграммные поля выражает условия устойчивости реагирующих фаз. Положение равновесных кривых позволяет судить о возможных превращениях в системе при заданном начальном состоянии, исходя из следующих условий:
Восстановление:
(РСО/ РСО2)г.ф > (РСО/РСО2)р;
Окисление:
(РСО/ РСО2)г.ф < (РСО/РСО2)р;
Равновесие:
(РСО/ РСО2)г.ф = (РСО/РСО2)р;
Если поддерживать в системе начальное состояние, отмечаемое на диаграмме точками, то будут развиваться окислительно-восстановительные процессы образования веществ, устойчивых в этом заданном состоянии. Например, для состава газовой фазы и температуры, отвечающие точке между кривыми 1 и 2 возможны следующие превращения:
Восстановление:
Fe2O3® Fe3O4® (FeО); Fe3O4® (FeO);
Окисление:
Fe® (FeО);
Неизменность (FeО) определенного состава.
Все газовые фазы, отмечаемые точками в поле устойчивости Fe, выражает условия развития только восстановительных процессов и невозможность окисления железа. Таким образом, выявляются предпосылки создания восстановительных или без окислительных атмосфер по отношению к определенному компоненту системы, по отношению к железу. Свойства исходных атмосфер подвержены существенному изменению при переходе от одного температурного уровня к другому.
Более поздние исследования реакций восстановления окислов железа в высокотемпературной области позволили полнее представить равновесную диаграмму и участие жидких реагирующих фаз. В верхней ее части обнаруживается линия перехода вюстита (FeО) в жидкий расплав окислов с очень небольшим изменением температуры плавления. Область жидкого расплава окислов ограничивается линиями, которые является продолжение кривой 2 выражает равновесие расплава окислов, содержащего Fe3O4, и газовой фазы СО-СО2 при различных температурах. Верхняя часть кривой 3 относится к равновесию жидкого вюстита (FeО)ж и железа с газовой фазы СО-СО2 и учитывает превращения железа вплоть до перехода в жидкое состояние.
Анализ диаграммы состояний системы Fe-О показал наличие в определенных интервалах температур и составов однородных областей растворов, в которых свойства окисла, его кислородный потенциал оказывается в зависимости от концентрации раствора:
РО2=¦(Т, N).
Такие области и зависимости обнаруживаются на равновесной диаграмме восстановления окислов, для которых можно предвидеть, что
РСО2/РСО= ϕ(Т, N).
имея в виду определенную взаимосвязь РО2 и РСО2/РСО. Это общая функциональная связь справедлива для области растворов твердого вюстита, области однородного расплава окислов и жидкого раствора железа. Каждому заданному составу такой системы N i должна соответствовать своя кривая температурной зависимости равновесного состава газовой фазы:
N i=пост. РСО2/РСО= ϕ (Т). (16)
Положение равновесных кривых, представленных на диаграмме Рис.2 для различных содержаний кислорода в растворах, установлено на основе экспериментальных исследований реакций восстановления твердого и жидкого вюстита. Полученные данные позволяет рассчитать активности железа и кислорода в вюстите и найти термодинамические функции таких растворов.
§3. Реакции восстановления окислов железа водородом также подчиняется общему закону последовательности превращений в порядке изменения термодинамических свойств окислов. Это соответствует схеме А.А. Байкова, по которой при температурах выше 570°С поочередно развивается реакции
восстановления:
1 → 3Fe2O3 +Н2® 2Fe3O4+ Н2О – ΔH1= 12,89 [кДж]
2 → Fe3O4+ Н2®3FeO + Н2О +ΔH2 = 77,54 [кДж]
3 → FeO+ Н2®Fe+Н2О +ΔH3 = 24,79 [кДж]
При температурах ниже 570°С вместо стадий 2 и 3 осуществляется непосредственное превращения магнитной окиси железа до железа:
4. 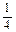 Fe3O4 + Н2 ®
Fe3O4 + Н2 ® FeO + Н2О ® ΔH4 = 37,97
FeO + Н2О ® ΔH4 = 37,97
Первая реакция является необратимой и развивается только в сторону восстановления окисла.
Диссоциирующей водяной пар не может обеспечить в системе превышение кислородного потенциала Fe2O3, что является необходимым условием образования последнего. В этих условиях состояние равновесие достигается со стороны реагирующего окисла. Различие физико-химической природе восстанавливаемого окисла и образующегося водяного пара обуславливает отрицательный тепловой эффект для трех реакций.
Как можно предвидеть на основе принципа смещения равновесии, эти реакции завершаются полнее при повышенной температуре. Ввиду неизменности числа молей реагирующего газа общее давление не должно оказывает влияние на конечное состояние. Дополнительное применение правила фаз к трехфазной двухкомпонентной системе позволяет установить общие функциональные зависимости равновесного состава газовой фазы для случая реагирования чистых фаз:
РН2О/РН2=¦(Т)
и растворов:
РН2О/РН2=ψ(Т, N).
Им соответствует на равновесной диаграмме кривые взаимодействия определенных окисных фаз и семейство кривых для области однородных растворов. В количественной форме эти функциональные зависимости показывает температурная функция константы равновесия. Ее выражение справедливо для всех реакции с участием конденсированных фаз постоянного состава:
Кр= РН2О/РН2 (17)
Числовое ее значение скачкообразно понижается от высшего окисла к низшему в соответствии с уменьшением величины кислородного потенциала:
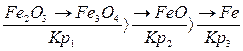
Количественные характеристики равновесия реакция восстановления окислов в различных температурных интервалах определяли экспериментальным и расчетным путем. В результате обобщения имеющегося материала можно рекомендовать следующие температурные функции для реакций  :
:
ΔG = –15547–74,46Т;
= –15547–74,46Т;
ln Кр = 813/Т+3,894; (18)
ΔG =71940–73,62Т;
=71940–73,62Т;
ln Кр = –3760/Т+3,85; (19)
ΔG =23430–16,16Т;
=23430–16,16Т;
ln Кр = –1225/Т+0,845; (20)
ΔG =35550–30,40Т
=35550–30,40Т
ln Кр= –1860/Т+1,59; (21)
На основе имеющихся к настоящему времени данных составлена полная диаграмма равновесие окислов железа с водородом и водяным паром (рис.3). Кривые в нижней ее части, имеющие нумерацию соответствующих реакций, отражает усредненные данные для реагирующих твердых фаз. Каждая из них показывает изменение состава равновесной газовой фазы с изменением температуры. По положению кривых легко судить о возможных превращениях в системе для заданного начального состояния исходя из следующих условий:
Восстановление:
(РН2/РН2О)г.ф > (РН2/РН2О)р;
Окисление:
(РН2/РН2О)г.ф < (РН2/РН2О)р;
Равновесие:
(РН2/РН2О)г.ф = (РН2/РН2О)р;
Например, для заданного состояния, отмеченного точкой в поле вюстита, предусматривается восстановление высших окислов или окисление железа до образования, в конечном итоге, твердого вюстита с определенным содержанием общего кислорода.

Рис.3. Диаграмма равновесии окислов железа с газовой фазой из Н₂ и Н₂О.
В полном согласии с правилом фаз в области существования однородного раствора вюстита и расплавов окислов имеется совокупность равновесных кривых, каждая из которых относится к определенному составу раствора. Довольная широкая область устойчивости железа в различных его соединениях, а также относительно невысокие содержания водорода в газовой фазе, обеспечивающие выделение железа, свидетельствуют о высокой восстановительной способности водорода при повышенных температурах по сравнению с окисью углерода. Для сравнения на (рис.4)
Сопоставлены равновесные кривые для обоих восстановителей. Их положение задается равенством кислородных потенциалов данного окисла и газовой фазы:
pО МеО ®pО газ
Для рассматриваемого окисла при постоянной температуре
pО МеО = пост.
Однако в газовой фазе такой потенциал может быть реализован при различных составах в зависимости от природы газа восстановителя. При сравнения свойств СО и Н2 и продуктов их окисления из которого следует:
pО МеО = 2RT ln РСО2/РСО+ ΔG = 2RT ln РН2О/РН2+ ΔG
= 2RT ln РН2О/РН2+ ΔG (22)
(22)
где, ΔG и ΔG
и ΔG –изменение энергии Гиббса реакция образования Н2О и СО к кислороду, тем выше соотношение РН2О/РН2 (РСО2/РСО), и для реализации одного и того же кислородного потенциала требуется более низкое содержания восстановителя в конечной газовой фазе. При сопоставлении кривых выявляется, что тройная точка превращение вюстита остается на неизменном температурном уровне 570°С. Кривые пересекаются в точке 810-820°С; при этой температуре восстановительные свойства СО и Н2 равны, так как
–изменение энергии Гиббса реакция образования Н2О и СО к кислороду, тем выше соотношение РН2О/РН2 (РСО2/РСО), и для реализации одного и того же кислородного потенциала требуется более низкое содержания восстановителя в конечной газовой фазе. При сопоставлении кривых выявляется, что тройная точка превращение вюстита остается на неизменном температурном уровне 570°С. Кривые пересекаются в точке 810-820°С; при этой температуре восстановительные свойства СО и Н2 равны, так как

Для температур выше 820°С

что выражает более высокое сродство водорода к кислороду и его более полное расходование на процесс. В температурном отношении водород оказывается более эффективным восстановителем в области повышенных температур.

Рис.4.Сопставление равновесных диаграмм восстановления окислов железа Н₂ (1) и СО (2).
При температурах ниже 820°С

Что требует меньше СО в конечном состоянии и отмечает его более высокую термодинамическую эффективность.
Таким образом, иное положение равновесных кривых для водорода является следствием другого значения характеристик сродства к кислороду и,в частности, других значений тепловых эффектов реакция как по знаку, так и по величине. Все это легко предвидеть ее основе общих закономерностей реакции водяного газа, в которой участвуют оба восстановителя: СО и Н2.
4. В производственных условиях большую роль играют процессы восстановления окислов при наличие в системе твердого углерода. Присутствующий твердый углерод обеспечивает, в конечном итоге, поддержание кислородного потенциала на таком уровне, при котором развиваются процессы восстановление определенных окислов. Предлагаемые при этом реакции прямого восстановления окисла углеродом:
МеО + С = Ме + СО
существенным образом отличаются от ранних изученных реакций с газообразном восстановителем, называемых в сравнении с первыми реакциями косвенного восстановления:
МеО + СО = Ме + СО2
Реакция между двумя твердыми компонентами окислом и углеродом ограничивается вследствие несовершенства контакта между ними. Контакт осуществляется только в отдельных местах непосредственного касания частиц окисла и углерода, возможно их прямое взаимодействие. Даже такой несовершенный контакт нарушается при появлении пленки продукта реакции. При этом появляется другое осложняющее обстоятельство, связанное с замедленностью диффузионного перемещения частиц углерода в твердых реагентов.
Это подтверждается известными данными о низком значении коэффициента диффузии углерода в железе даже при высоких температурах. Скорости превращений значительно превосходит диффузионный перенос углерода и процесс развивается в таких системах, в которых продукт реакции - металл практически вообще не растворяет углерод.
Высказанные соображения, как и различные опытные факты, оправдывают ранее предложенную А.А.Байковым схему реагирования. По которой прямое восстановление является суммарным результатом реакции косвенного восстановления и газификации углерода:
МеО+СО ↔Ме+СО2
СО2+С ↔2 СО

МеО+С ↔ Ме+СО
Затрачиваемый по первой реакции газообразный восстановитель восполняется по второй реакции (превращения СО2 в СО). Соотношение между последними в конечном состоянии регулируется равновесием реакции газификации в
зависимости от создавшихся в системе условий. В общем случае в газовой фазе должны быть как СО, так и СО2. при значительных содержаниях СО2 в области пониженных температур реакцию прямого восстановления можно представить схемой:
2МеО+С=2Ме+СО2
Однако практическое значение имеют высокотемпературные превращения, развивающиеся по схеме А.А.Байкова. Превращения окислов железа можно представить следующими реакциями прямого восстановления:
1. 3Fe2O3 +С® 2Fe3O4+ СО – ΔH1 =118,82 [кДж]
2. Fe3O4+ С®3FeO + СО +ΔH2 = 209,26 [кДж]
3. FeO+ С®Fe+СО +ΔH3 = 156,50 [кДж]
Величины тепловых эффектов свидетельствуют о существенном влиянии температурного фактора на завершенность реакций. Ввиду изменения числа газообразных частиц в реакции конечное состояние реагирующей системы оказывается в зависимости от давления. Прямое восстановление полнее при пониженных давлениях согласно принципу смещения равновесия реакций.
Каждая из отдельных реакций схемы (34) и суммарное превращение в системе могут развиваться при известных условиях в зависимости от состава газовой фазы и равновесных данных. На рис.4 сопоставлены равновесные кривые отдельных реакций рассматриваемой схемы. Развитие реакции восстановления через газовую фазу возможно при условии:
РСО.(г.ф)> РСО(р),
а реакции газификации:
РСО.(г.ф)< РСО(р).
Как следует из сопоставления кривых, одновременное осуществление обеих реакций возможно только начиная с определенной температуры, характерной для каждого окисла: Fe3O4~Т2; FeO~Т3 и т.д. По достижении такой температуры превращениях, называемое прямым восстановлением. Точка пересечения кривых выражает равновесие сложной четырехфазной системы с тремя компонентами:
С=К+2-Ф=3+2-4=1.
В соответствии с одной степенью свободы температура однозначно задает равновесие общее давление и парциальное давление СО:
Р=¦(Т).

Рис.5. Сочетание равновесных кривых реакций газификации углерода и восстановления окислов железа.
При температуре Т2 реализуется равновесное сложной системе
Fe3O4+ FeO-С-СО- СО2
a при Т3 Системы
FeO- Fe-С-СО- СО2
При понижении давления в системе равновесия кривая газификации углерода смещается к более низким температурам. В полном согласии с общем выражением (3,65) при этом понижаются температуры, при которых начинается реагирование углерода. Аналитически рассматриваемые зависимости можно представить на основе температурных функций констант равновесия реакции восстановления окислов и газификаций углерода:
Кр= РСО2/РСО=¦(Т);
Кр(4,1)= РСО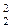 /РСО=ψ(Т);
/РСО=ψ(Т);
РСО2+РСО=Р;
Совместное решение уравнений позволяет рассчитать температуру начало реагирование углерода для заданного давления и состав равновесной газовой фазы. Таким путем можно предвидеть условия прямого восстановления других окислов в зависимости от их природы. С повышением прочности окисла понижается его кислородный потенциал и, как показывает соотношение (32), возрастает содержание восстановителя в равновесной газовой фазе. Кривая равновесия восстановления окисла приближается к оси 100%-ного содержания СО, что выражает низкую эффективность использования восстановителя (рис.5). При этом значительно возрастает температура начало прямого восстановления при участие углерода, например Т5 для кривой 5, представленной на графике в увеличенном масштабе. В этом случае можно существенно улучшить термодинамических условия восстановительных процессов путем применение вакуума. Как показывают качественные зависимости и количественные расчеты на основе уравнений (39), разрежение в системе понижает температуру начало прямого восстановления и обеспечивает более полное использование восстановителя. Эти общее закономерности служит предпосылками вакуумной металлургии при получение металлов с повышенном сродством к кислороду.
Аналогичном образе можно выявить условия развитие окислительных процессов при наличие в системе избытка углерода:
Для реагирующих окислов
РСО.(г.ф)< РСО(р).
Для реакции углерода
РСО.(г.ф)> РСО(р),
Такие условие реализуется при температурах ниже точек пересечения равновесных кривых (рис.5) и обусловливает окислительные процессы:
В области Т2-Т3
Fe® (FeO);
и ниже
Fe® (FeO);
(FeO) ® Fe3O4;
несмотря на присутствие избытка твердого углерода.
Рассмотренные закономерности опираются на термодинамику макросистемы, и выражает его свойства в целом. Однако для твердого углерода известны сильно развитые поверхностные явления. Твердый углерод адсорбирует большие объемы кислорода и выделяет при небольшом повышении температуры газ, богатый СО. С другой стороны, прочные межатомные связи в решетке графита нарушаются благодаря внедрению в межбазисное пространство посторонних частиц. Подобного рода явление могут быть причиной местного активирования прямого восстановления окисла и кинетического температуры начала процесса могут отличаться от термодинамических. В этом отношении интересны исследования В.П. Елютина и Ю.А. Павлова. Восстановителем служил радиоактивный изотоп углерода, а начало взаимодействия определяли по появлению радиоактивности в газообразных продуктов реакции. Найденные температуры начала восстановления увеличиваются при переходе от одного окисла к другому в порядке повышения термодинамической их прочности при осуществлении очередной ступени превращении (V2O5-711 К; Fe3O4-758 К; TiO2-1208 К). Эти величины составляют определенную долю температур плавления окислов и соответствуют необходимому разрыхлению кристаллической решетки окисла к началу его восстановления. Опираясь на полупроводниковые свойства окислов, авторы показали, что начало восстановления практический совпадает с появлением у окислов собственной электропроводности, которая, как и химическая активность, связана с определенной концентрацией свободных электронов.
Опубликованный экспериментальный материал показывает, что закономерности кинетики процесса прямого восстановления окислов в той или иной мере отражает признаки частных реакций, из которых он сочетается. Во многих случаях интенсивность процесса изменяется аналогично изменению интенсивности частных реакции газификаций углерода. Ускоряющие влияние оказывает такие добавки, которые активируют взаимодействие С с СО2.
С другой стороны неоднократно отмечались случай полного заимствование восстановителя на другую частную реакцию косвенного восстановления, относительно который успевал устанавливаться равновесный состав газовой фазы.
Подобного рода факты свидетельствует о замедленности реакции газификации углерода, лимитирующий сложный процесс в целом. Относительного показателем этого может служить величина кажущейся энергии активации процесса прямого восстановления, определяющая температурную зависимость константы скорости:
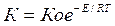
Е=ЕС+¦(pО).
Величина Е процесса слагается из значения кажущиеся энергии активации газификации углерода (175850-217710 дж/моль, или 42000-52000 кал/моль) и дополняется величиной функции, связанной с кислородным потенциалом окисла и энергии Гиббса реакции косвенного восстановления. Для относительно прочных окислов
¦(pО)®0;
Е= ЕС,
и кажущейся энергия процесса (146540-230270 дж/моль, или 35000-55000 кал/моль) близка к таковой для реакции газификации, но значительно выше значений для реакции косвенного восстановления (62800-79550 дж/моль, или 15000-19000 кал/моль).
Для более прочных окислов
¦(pО) > 0;
Е > ЕС
и величина Е процесса увеличивается на значение ¦ (pО) в зависимости от природы окисла и термодинамических характеристик реакции косвенного восстановления (293080-418680 дж/моль, или 70000-100000 кал/моль). Однако известны факты смещения процесса к другому пределу, когда лимитирующая роль начинает замедленная частная реакция косвенного восстановления. Это проявляется в опытах, условия которых благоприятны для развития взаимодействия С с СО2. При этом Е процесса оказывается небольшой величиной, близкой к кажущейся энергии активации восстановления окисла газообразным компонентом (41870-71180 дж/моль). На кинетических кривых обнаруживаются признаки автокатализа, характерные для реакции косвенного восстановления.
Следует отметить в виду взаимное влияния одной частной реакции на другую, равно как и поверхностные явления. Все это содействует развитию процесса прямого восстановления в условиях, когда затруднено осуществление изолированной частной реакции.
5. Помимо углерода, другие металлы и неметаллы могут также проявлять свои восстановительные свойства. Об этом свидетельствует различие в величинах ΔG°(МеО) образования окислов, выражающие различие в химическом сродстве элементов к кислороду. В силу этого металл более высоким сродством к кислороду Ме² заимствует кислород у менее прочного окисла с выделением другого металла Ме¢:
Ме¢О+Ме²= Ме²О+ Ме¢;
Такие превращения являются основой важных для практики металлотермических процессов получения без углеродистых металлов и сплавов. Их анализ возможен на основе сравнения ΔG°(МеО) образования реагирующих окислов, что предусматривает общая теория восстановительных процессов. Величина ΔG° написанной реакции (41) определяется свойствами реагирующих окислов из соотношения
ΔG°=0,5
ΔG°= 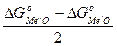 (1)
(1)
Согласно общей теории восстановительных процессов, условия реагирования системы следующие:
Восстановление: ΔG°<0; ΔG°Ме¢О > ΔG°Ме²О
Равновесие: ΔG°=0; ΔG°Ме¢О=ΔG°Ме²О
Таким образом, значение ΔG° реакции и полнота ее завершения тем выше, чем больше разница в ΔG°МеО образования реагирующих окислов.
Аналогичным образом нетрудно выявить возможности алюмотермического процесса для тех окислов, кривые для тех которые располагается выше ΔG° образования Al2O3. примером может служить реакция получения ванадия, нашедшая широкое применение при выплавке феррованадия:
2/5 V2O5+ 4/3 Al= 4/5 V+ 2/3 Al2O3. – ΔH;
ΔG°= –112140+14,57T (2)
Возможность успешного применения силикотермического процесса демонстрирует реакция выделения молибдена при выплавке ферромолибдена:
2/3 МоО3+ Si= 2/3 Мо+ SiO2 – ΔH;
ΔG°=–112140+15,65Т (3)
Для металлотермических процессов важной характеристикой оказывается количество выделяемого тепла на единицу реагирующей массы (термичность шихты). О таких возможностях процесса можно судить по соотношению
Q= ΔH Ме²О–ΔH Ме¢О (4)
Для примерной оценки можно полагать, что величина Q связана с термодинамической эффективностью металлотермического процесса выражаемой уравнением (4).
При достаточном тепловыделении в результате экзотермических реакций обеспечиваются подержание реагирующих веществ в жидком состоянии и внепечная выплавка ферросплава.
Другим важным обстоятельством является изменением свойств реагирующих веществ в реальных процессах под влиянием дополнительных явлений (например, плавления, растворения). Эти дополнительные явления, изменяющие взаимное положение кривых для окислов, можно оценить на основе выражения кислородного потенциала окислов:
pО=ΔG°МеО–RT ln (a ²Ме/ а ²МеО) + ∑ ΔG° Ме, МеО. (5)
Стандартная величина ΔG°(МеО) для окисла изменяется под влиянием растворения Ме и МеО и агрегатных превращений, что выражает второй и третий члены уравнения. Показатель второго относится к реакции двухвалентного металла и в других случаях заменяется на стехиометрические коэффициенты при Ме и МеО для реакции, отнесенный к молю реагирующего кислорода.
Система реагирует до выравнивания потенциалов обоих окислов, что достигается в конечном равновесном соотношении:
pО Ме¢О = pО Ме¢¢О
Эффективность же металлотермического процесса определятся величиной неравенства
pО Ме¢О > pО Ме¢¢О
ΔG°Ме¢О – RT ln (а ²Ме¢/ а ²Ме¢О) + ∑ (ΔG°) Ме¢, Ме¢О >
> ΔG°Ме²О – RT ln (а ²Ме²/ а ²Ме²О) + ∑ (ΔG°) Ме², Ме²О (6)
Неравенство (6) выявляет различные способы повышение эффективности процесса. Этому содействует увеличение pО Ме¢О, что достигается путем:
1) растворения в металлическом растворителе образующегося Ме¢ и понижения а Ме (а < 1);
2) поддержания во время процесса а Ме¢О®1;
3) перехода Ме¢ в жидкое и особенно в парообразное состояние.
Понизить величину pО(Ме¢¢О) можно следующими путями:
1) применением чистого металлического восстановителя (а Ме¢¢О®1);
2) плавлением образующегося окисла Ме²О и его ошлаковыванием.
3) понижением активности окисла Ме²О при дополнительном введении флюса (а Ме¢¢О < 1)
Как показывает соотношение (1), отмеченные факторы содействуют более полному завершению процесса и выделению в конечный сплав восстанавливаемого элемента. Обширные исследования, выполненные В.П. Елютиным с сотрудниками, не только освещают теорию металлотермических процессов, но и отражают большую работу по практическому осуществлению их при производстве ферросплавов.
6. Из рассмотренных общих закономерностей восстановительных процессов следует, что вероятность развития и полнота превращений тесно связана с природой реагирующих окислов. В реальных производственных процессов участвует не только чистые окислы; часто источником получения металла оказывается более сложные химические соединения, которые подвергаются восстановлению. Наряду с этим создаются благоприятные термодинамические условия образования вместо простых окислов более сложных промежуточных соединений в естественной последовательности их превращении от высшего к низшему. Наконец, конечным продуктом может быть не чистый металл, а его соединения с другим элементом. Картина еще более усложняется при образования растворов как в металлической, так и в окисных фазах. При этом важно оценить изменении физико-химических свойств окисла под влиянием дополнительных процессов и предвидеть новые условия их восстановления. Для этих целей может служить выражение кислородного потенциала:
pО(МеО) = ΔG° (МеО) – RT ln а²Ме+ RT ln а²МеО + ∑ (ΔG°) Ме, МеО (1)
Оно показывает, как влияют образование растворов и изменение активности а Ме и а МеО, а также агрегатные переходы ∑ (ΔG°) Ме, МеО на прочность окисла, определяемому ΔG°МеО реакции 2Ме+О2=2МеО.
Выражение кислородного потенциала для газовой фазы: pО (МеО) 2RT ln (РСО2/РСО)²·1/Кр(1,2)
позволяет определить полноту восстановительного процесса и конечный состав газовой фазы при равновесии, для которого справедливо равенство
pО (МеО) =pО (г.ф)
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 809; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 < 0
< 0 = (Р
= (Р