
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Блиц – тест. Спокойная сталь – раскисленная сталь которая при затвердевании в изложницах ведет себя спокойно, т. е. из нее почти не выделяются газы.
|
|
|
|
Глоссарии
Спокойная сталь – раскисленная сталь которая при затвердевании в изложницах ведет себя спокойно, т. е. из нее почти не выделяются газы.
Кипящая сталь - низкоуглеродистая сталь, содержащая достаточно оксида железа для того, чтобы непрерывно образовывался монооксида углерода при затвердевании слитка, что приводит к отсутствию усадочной пористости на поверхности и периферии металла.
Легированная сталь – сталь в составе которого помимо обычных примесей содержится легирующие примеси либо содержание кремния и марганца в которой повышено против обычного количества.
Переплавные процессы – это процессы переплава стали, предварительно выплавленной в «обычном» агрегате (конвертере или дуговой печи)
Рафинирование металлов — процессы очистки первичных (черновых) металлов от нежелательных примесей или примесей, представляющих самостоятельную ценность. Различают 3 основных метода рафинирования металлов: пирометаллургический, электролитический и химический
Дефосфорация - удаление фосфора из расплавленного чугуна, стали. При окислительного дефосфорации фосфор в металле связывается в Р2О5 с СаО основного шлака который прочно удерживается в шлаке в виде фосфата кальция.
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
Литература:
- Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
- Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
- Теория металлургических процессов. С.И. Филиппов. М: Металлургия, 1967 – 279 с
Лекция №9 «Строение и свойства металлургических расплавов»
План лекции:
1.Жидкие металлы и шлаки. Общая характеристика и строение жидких металлов и шлаков.
2.Дифракционный анализ структуры жидких металлов и сплавов. Определение структурно – чувствительных свойств. Потенциал Леннарда – Джонсона.
3.Физические свойства жидких металлов. Вязкость жидких металлов. Плотность.
4. Поверхностное натяжение жидких металлов. Электрические свойства жидких металлов. Электрическое сопротивление. Определение температурного коэффициента электрического сопротивления.
5. Жидкие шлаки. Строение жидких шлаков. Химический и минералогический составы шлаков. Ионное строение шлаков.
6.Ионная теория, ее развитие. Ионные расплавы в современной технике.
7.Диаграммы состояний шлаковых систем. Двухкомпонентные системы (SiО2-Аl2O3; СаО-Аl2O3).Трехкомпонентные системы. Метод Гиббса, метод Розенбума.
8.Физико – химические свойства шлаков. Плотность и мольные объемы, поверхностные свойства, вязкость, диффузия в ионных расплавах.
Цель лекции:
Ознакомление с строением и свойствами металлургических расплавов
Дидактические единицы:
шлак; классификация; роль шлаков; вязкость; основность; ионы; оксиды; кислотность.
1. Большинство металлургических процессов протекает в условиях взаимодействия металлической, газовой и шлаковой фаз. Последняя образуется из различных окислов и химических соединений и выполняет сложные технологические функции. Правильно осуществляемый шлаковый режим обеспечивает высокую производительность металлургических агрегатов и требуемое качество металла.
В доменном процессе невосстановившиеся окислы образуют шлак — первичный, промежуточный и конечный. К этим окислам относятся окислы кремния -Si, кальция -Ca, магния -Mg, алюминия -Al, марганца -Mn и в небольшом количестве закись железа -Fe.
В формировании сталеплавильных шлаков принимают участие окислы, образующиеся при окислении кремния -Si, марганца Mn, фосфора -P, хрома -Cr, железа -Fe и других элемеитов, входящих в состав металлической части шихты, а такж железная и марганцевая руда, известь, боксит, изношенные участки футеровки. В состав шлаков также входят сульфиды и различные химические соединения.
Обширный материал о минералогической структуре металлургических шлаков и показывает, что в различных твердых шлаках можно обнаружить сотни минералов: 70% составляют силикаты и алюмосиликаты, около 14% —шпинели, 4% —свободные окиси и 9% —различные минералы.
В основных шлаках обнаружены следующие группы минералов:
1. Силикаты (СаОМg-О-SіО2 — монтичеллит,
2СаО-SiO2-ортосиликат кальция, 2МgO-SiO2— форстерит, СаО-SiO2— воллостонит, СаО-МgО-SiO2 — пироксен и диопсид,
2Мg-FеО-SіО2 — оливин);
2. Алюмосиликаты (СаО-А12О3-SiO2, 2СаО-А12О3 • SіО2);
3. Шпинели (МgО-Fе2Оз — магноферрит, 2СаО-Fе2О3— феррит кальция, FеО • Сr2Оз — хромит, МgО • Сr2О3 — хромомагнезиальная шпинель);
4. Свободные окислы (СаО, FеО, МпО, МgО);
5. Фосфаты (ЗСаО-Р2О5, 4СаОР2О5, 3FеО-Р205);
6. Сульфиды (СаS, МnS, FеS и МgS).
Важной технологической характеристикой металлургических шлаков служит основность, определяемая одним из отношений
B = 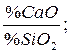
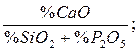
 ;
;
B = 
К главным окислам сталеплавильных шлаков относятся СаО, SiO2 и FеО. Первый из них определяет свойства основных шлаков, второй — кислых шлаков, третий — окислительные свойства шлаков. Кислые сталеплавильные шлаки содержат
50—60% Sі02, основные – 15 - 30% SіО2, возможны и промежуточные составы.
К главным окислам шлаков доменного процесса относятся СаО SіО2 и А120з. Из приведенных данных следует, что металлургические шлаки представляют собой силикатные системы.
В металлургических процессах шлак должен выполнять следующие важные функции:
- служить регулятором направленности химических реакций в сторону окисления или восстановления тех или иных элементов;
- создавать благоприятные условия для удаления из металла вредных примесей — серы и фосфора;
- обеспечивать необходимую скорость передачи тепла металлической ванне и питание кислородом (в случае окислительной плавки);
- не допускать поглощения металлической ванной больших количеств вредных газов (водорода и азота) и адсорбировать выплывающие из металла неметаллические включения;
- не допускать больших потерь железа и других ценных компонентов металлической ванны в виде химических соединений с кислородом (угар).
Указанные функции металлургические шлаки могут выполнять только тогда, когда они будут обладать определенными физико-химическими свойствaми. Важнейшие физические свойства шлаков:
- степень черноты, характеризующая способность шлака к поглощению лучистой энергии;
- теплопроводность, определяющая скорость нагрева металлической ванны;
- вязкость, влияющая на кинетику процессов, в которых шлак участвует как передающая промежуточная среда и как реагирующее вещество;
- поверхностное натяжение, которым определяются процессы адсорбции неметаллических включений, всплывающих из ванны.
2. При изучении свойств металлургических шлаков используют двойные диаграммы состояния окислов SіО2 — СаО, СаО — А12Оз, SіO2 — А12О3, SіO2 — FеО, а также тройную диаграмму состояния СаО — SіО2 — А12О3.
Диаграмма состояния системы SіО2 — СаО. Рассматриваемую диаграмму состояния образуют два окисла (SіО2 и СаО) различной физико-химической природы. Эта система включает следующде химические соединения:
- метасиликат СаSіО3 или СаО-SіО2, встречающийся в двух модификациях — а и |3;
- пиросиликат'Са3Sі207 или ЗСаО-2SіО2;
- ортосиликат Са3SіО2, называемый также ларнитом;
- аллит Са3SіО2.
По характеру перехода в жидкое состояние различают два типа соединений. К первому относятся кристаллические вещества, плавящиеся конгруэнтно, у которых химический состав, образующийся при плавлении жидкости, такой же, как у твердого соединения. Ко второму типу относятся соединения, плавящиегя инконгруэнтно, когда химическое соединение при температуре плавления распадается и состав жидкой фазы не соответствует составу твердого вещества. При этом образуется новая твердая фаза.
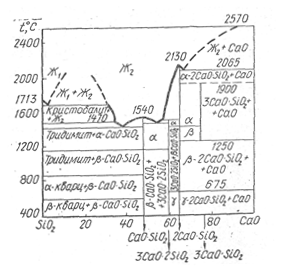
Рис 1. Диаграмма состояния системы Sі02—СаО,
По виду максимума на кривой ликвидуса можно судить о прочности химических соединений — чем положе максимум, тем менее прочно соединение и тем выше степень диссоциации.
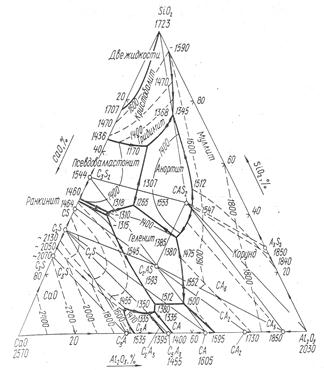
Pис. 2. Диаграмма состояния системы СаО—Sі02—А12О3
Тройная диаграмма состояния системы СаО — SіО2 — А12О3. Из тройных систем в настоящее время наиболее изученная система СаО —SіО2 — А12О3 (рис. 2), составляющая основу доменных шлаков. В этой системе образуются два тройных химических соединения:
СаО-А12О3-2SіО2 — анортит с температурой плавления 1550°С; 2СаО-А12О3-SіО2 — геленит с температурой плавления І590°С.
Для удобства написания формул химических соединений в равностороннем треугольнике рассматриваемой системы введены условные обозначения: - С — СаО; А —А1203; 3 — Sі02. Так, анортит обозначается САS2, геленит — С2АS.
3. В настоящее время существуют три теории строения жидких металлургических шлаков — молекулярная, ионная и теория, учитывающая наличие ионных и ковалентных связей в соединениях шлаков.
Молекулярная теория исходит из того, что все химические соединения в шлаках имеют ковалентную связь. Эта теория учитывает только термическую диссоциацию сложных соединений на простые и не принимает во внимание электролитическую диссоциацию окислов (типа МеО), имеющих ионную связь.
Основой молекулярной теории являются следующие положения:
─ жидкие шлаки представляют собой раствор, содержащий молекулы как свободных окислов, так и связанных в химические соединения;
─ между молекулами свободных и связанных окислов существует подвижное химическое равновесие;
─ активными, непосредственно реагирующими с металлами явля-ются лишь молекулы свободных окислов СаО, SіО2, МпО, FеО, Р205, Сг2О3 и др.
Согласно молекулярной теории в состав металлургических шлаков входят основные, кислотные и амфотерные окислы, силикаты, фосфаты, алюминаты, ферриты и сульфиды. Пользуясь молекулярной теорией, можно определить активность закиси железа в основном сталеплавильном шлаке. Так как закись железа растворяется в шлаке и металле, то по закону распределения при равновесии справедливо соотношение
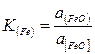 или
или 
где а (FeO) и a [0] — активности FеО в жидком шлаке и кислорода в металле.
Активность кислорода, растворенного в металле, пропорциональна его содержанию вплоть до насыщенных растворов. За стандартное состояние, когда а [о] = 1, принимается расплав чистой закиси железа (точнее 94% FеО и 6% Fе2О3) при 1600°С. Содержание кислорода в чистом железе под таким расплавом составляет 0,23 %. Тогда
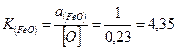
откуда активность закиси железа в шлаке а (FeO) = 4,35[О].
Т а б л и ц а 1. Данные о температурах плавления,, температуре максимума на диаграммах состояния систем и изменениях 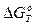 при образовании некоторых силикатов и алюминатов
при образовании некоторых силикатов и алюминатов
| Химические реакции | Температура плавления соединений, °С | Характер максимума |  реакций,
кДж реакций,
кДж
| 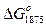 кДж
кДж
|
| 2FеО + SiO2 = Fе2SiO 4 | Пологий | - 28700+ 3,34 Т - 47400+ 2,51 Т - 89200+ 0,51 Т - 137300- 4,98 Т - 19300-17,6 Т - 56900- 3,35 Т -18800- 6,281 Т | -22300 -42600 -87300 -146600 -52400 -63200 -30700 | |
| 2МпО + Sі02 = Мn2SіО4 | То же | |||
| СаО + SіОа = Са SіО3 | ||||
| 2СаО + SіО2=Са2Sі04 | Острый | |||
| СаО + А12О3 = СаА12О4 | Пологий | |||
| 2МgО + SiO2 = МgSiO4 | Острый | |||
| МgО + Аl203 = МgАІ2О4 | Пологий |
Молекулярная теория удовлетворительно согласуется с диа-граммами плавкости различных шлаковых смесей (SіO2 — СаО; СаО—А12О3; FеО — SіО2 и др.). В табл. 1 представлены данные о температурах плавления, характере максимума на диаграммах состояния систем и изменении изобарного потенциала при образовании некоторых силикатов и алюминатов. Наиболее высокие значения  соответствуют образованию силиката 2СаО-SіО2, имеющего острый максимум.
соответствуют образованию силиката 2СаО-SіО2, имеющего острый максимум.
4. Ионная теория строения металлургических шлаков разработана советскими учеными М. И. Темкиным, О. А. Есиным, А. М. Самариным, Л. А. Шварцманом и другими на основе общей теории совершенных ионных растворов. Ионная теория исходит из того, что многие расплавленные соли и шлаки обладают значительной ионной электропроводностью.
Для совершенного ионного раствора характерно то, что он состоит из ионов, вблизи любого иона, как и в кристаллах, расположены противоположно заряженные ионы. Одноименно заряженные ионы равноценны в отношении их взаимодействия с соседними ионами; образование раствора из компонентов протекает без теплового эффекта.
Экспериментальная база ионной теории строения шлаков значительно шире, чем молекулярной. Она основывается не только на результатах химического, минералогического и физико-химического анализов, но и на данных других современных методов исследования твердых и жидких шлаков.
Согласно ионной теории строения металлургических шлаков окислы, их соединения и сульфиды в шлаке диссоциированы: окиcлы и сульфиды на соответствующие катионы Са2+, Мg2+, Мп2+, Fе2+ и анионы кислорода O2~ и серы S2~; соединения окислов (силикаты, фосфаты, алюминаты, ферриты) на соответствующие катионы и сложные анионы SіО4- РО3-~, АlО2-~, FеО-2 ~
Преимущества ионной теории особенно заметны при рассмотрении таких явлений, которые не в состоянии объяснить молекулярная теория: электропроводность жидких шлаков, возможность электролиза шлаков, существование скачка потенциала на границе металл - шлак, электрокапиллярные явления.
Согласно молекулярной теории при взаимодействии металлической и шлаковой фаз происходит обмен незаряженных частиц. Согласно же ионной теории через границу раздела фаз переходят заряженные частицы. Наряду с возникновением электрического потенциала протекают процессы, ликвидирующие дальнейшее накопление зарядов. К таким процессам относятся переходы ионов железа из шлака в металл, восстановление ионов трехвалентного железа до двухвалентного, переход ионов кислорода из металла в шлак и др. В качестве примеров рассмотрим следующие комбинации.
1. Одновременный переход катионов и анионов в одних и тех же направлениях:

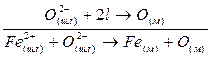
2. Одновременный переход анионов в различных направлениях:


3. Одновременный'переход катионов в противоположных направлениях:

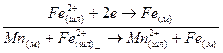
А. М. Самарин, Л. М. Шварцман, М. И. Темкин показали, что ионная теория применима для расчета распределения серы между железоуглеродистыми расплавами и шлаком. Активности отдельных компонентов шлаков, вычисленные с применением ионной теории, приближались к экспериментально найденным только при небольших концентрациях SіО2 в шлаке (порядка до 10 вес. /о).
При более высоком содержании SіО2 в шлаке в уравнение для расчета константы распределения серы между металлом и шлаком необходимо ввести соответствующие коэффициенты активности

где х3 — процент (по массе) серы в металле.
Определение активностей отдельных компонентов шлаков или условно молекул, образуемых этими компонентами, производится по такой схеме: активность сульфида железа

активность закиси железа

Ионные доли определяются отношениями числа молей данного иона к сумме граммионов того же знака. В cоответствии с этим ионные доли железа, серы и кислорода находятся из уравнений
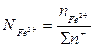
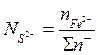
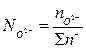
Значения чисел молей соответствующих ионов вычислятся по данных химического анализа. Основные окислы шлака диссоциируют по схеме МеО = Ме2+ + О2~. Это означает, что пре2+ = «Еео; гамп2+ = «мпо и т. д. Тогда сумма молей всех катионов 2я+ находится из соотношения
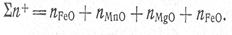
Образование комплексных анионов схематично можно представить такими уравнениями:
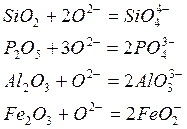
Число молей анионов S2-~ и SіО4-~ определяется из соотношений
 и
и 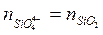
Общее число молей ионов кислорода находится так:
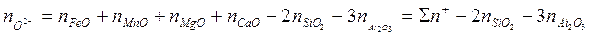
Сумма моль-ионов всех анионов составляет
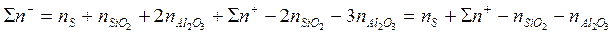 Таким образом, активности ҒеS и FеО рассчитываются по уравнениям
Таким образом, активности ҒеS и FеО рассчитываются по уравнениям
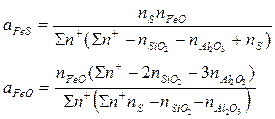
Для шлаков, которые могут быть отнесены к совершенным ионным растворам, активности их компонентов равны произведению ионных. долей тех ионов, на которые диссоциируют компоненты.
Реакции распределения отдельных ионов схематически записываются следующим образом:
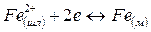


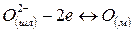
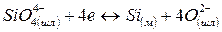
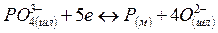
Эти уравнения отражают начальные и конечные состояния, что необходимо для определения условий равновесия, но недостаточно Для выяснения механизма и кинетики процессов. Равновесная разность потенциалов для каждого из указанных выше электродных процессов соответственно составит:
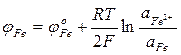
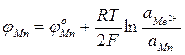
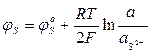
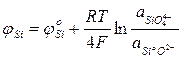
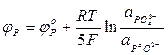
Если в состоянии равновесия на границе металл — шлак устанавливается единый электрический потенциал, то
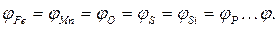
Приравняв правые части уравнений можно установить условия равновесия для различных взаимодействий.
§ 5. Теорию строения шлаков с учетом ионной и ковалентной связей I разработал Н.М.Чуйко. Эта теория учитывает как термическую, так и электролитическую диссоциации соединений и позволяет объяснить физические и химические свойства шлаковых систем на основе диаграмм состояний, электропроводности, активности компонентов шлака, распределения элементов между шлаком и металлом и др.
О характере химической связи можно судить по электропроводности шлаковых расплавов, поляризуемости ионов, изменению величины теплового эффекта реакции, сумме радиусов катионов и анионов и другим характеристикам.
При плавлении вещества доля ионной связи несколько уменьшается или остается неизменной.
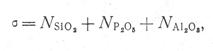
В.А.Kожеуров разработал метод расчета активностей в основных сталеплавильных шлаках. В основу этого метода положено представление о том, что шлаки являются регулярными ионными растворами и состоят из простейших одноатомных катионов Fе2+, Мn2+, Са2+, Мg2+, Sі4+, Р5+, окруженных анионами О2~, и не содержат комплексных ионов. В соответствии с теорией регулярных ионных растворов учитывается не только энтропия, но и теплота смешения ионов или энергия взаимодействия между ними.
Общее число и ионная доля катионов определяются из соотношений
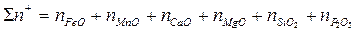
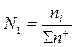
Расчет ионных долей катионов произврдится исходя из соотношений
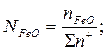
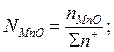
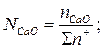
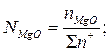
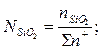

В.А.Кожеуров предложил следующие уравнения для расчета коэффициентов активностей в рассматриваемой системе:
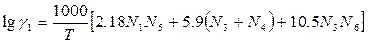
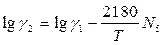
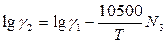
Приведенные формулы относятся к сильно основным шлакам. Результаты расчета по этим формулам хорошо согласуются с экспериментальными данными о распределении кислорода между шлаком и металлом в реакциях окисления марганца и фосфора.
§ 6. Зависимость вязкости жидкостей от температуры, как указывалось выше, описывается уравнением Я. И. Френкеля
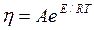
где А — постоянная величина; Е — энергия активации вязкого течения.
По экспериментальным данным установлено, что температурная зависимость вязкости простых недиссоциированных жидкостей подчиняется экспоненциальному закону. Отклонение от этой закономерности наблюдается у ассоциированных жидкостей, к числу которых относятся металлургические шлаки.
Так как металлургические шлаки являются в основном силикатными системами, то для получения представлений об их структуре целесообразно рассмотреть кристаллические решетки твердых силикатов. Все модификации SіО2 построены из кремнекислородных тетраэдров, в которых атомы кремния занимают центральное положение, а атомы кислорода, окружающие атом кремния, располагаются в вершинах тетраэдров.
Вязкость жидкоcтей расплавленных металлов и шлаков определяется при помощи приборов, называемых вискозиметрами. Наибольшее распространение получили вискозиметры торсионные, ротационные и вибрационные.
Понятие вязкости обычно относят к гомогенным жидкостям. Вязкость шлаков является действительной вязкостью только при температурах выше температуры начала их кристаллизации. При температурах между линиями ликвидуса и солидуса шлаки, хотя и находятся в подвижном состоянии, представляют собой гетерогенную систему. Замеряемая вязкость в таких температурных интервалах — кажущаяся.
При изготовлении углеродистых и легированных сталей ответственного назначения шлаки применяются для особо глубокой десульфурации, раскисления и удаления неметаллических включений. К таким шлакам относятся известково-глиноземистые синтетические (предназначаемые для внепечной обработки металла, т.е. в ковшах); шлаки для электрошлакового переплава; шлаки, образующиеся при сгорании экзотермических смесей и др. Эффективность действия указанных шлаков определяется их химическим составом и вязкостью при соответствующих температурах.
Вязкость основных шлаков понижают такие компоненты, как А12О3, Р2О5, и особенно СаF2.
Вязкость кислых шлаков понижается с увеличением концентрации основных окислов FеО, МпО, СаО и МgО.
Kак показали результаты исследований, наиболее значительное повышение температуры плавления конвертерного шлака, связано с появлением двухкальциевого силиката 2СаО-SіО2.
После определения вязкости проб шлака наблюдалось значительное уменьшение содержания в них СаF2, что свидетельствует oб улетучивании значительной части фтора и, следовательно, о кратковременности разжижающего действия СаF2. Исходя из этого плавиковый шпат следует вводить в конвертер небольшими порциями по ходу плавки.
§ 7. Вспенивание жидкостей также связано с поверхностными явлениями. При вспенивании основных мартеновских шлаков ухудшается передача тепла и кислорода из атмосферы печи, замедляются физико-химические процессы взаимодействия металла и шлака, повышается температура свода в результате перегрева шлака с поверхности и увеличивается уровень шлака в печи.
На основании исследований, проведенных при низких температурах с различными веществами, установлено, что вспениваемость жидкостей обусловлена низким поверхностным натяжением на границе жидкость — газ при наличии прочных адсорбционных пленок. Пена представляет собой дисперсную систему, состоящую из заполненных газом ячеек, разделенных между собой пленками жидкости. Она является неустойчивой системой, так как обладает большим запасом поверхностной энергии на границе фаз жидкость — газ. При пенообразовании значительно увеличивается поверхность, чему способствует малое поверхностное натяжение жидкости на границе с газом.
Для образования устойчивой пены низкое поверхностное натяжение на границе жидкость — газ необходимое, но недостаточное условие. Большое значение имеет механическая прочность поверхностных пленок и способность их претерпевать без разрушения значительные деформации. Вещества, добавляемые в небольших количествах в систему, способствующие возникновению на границе раздела фаз адсорбционных слоев и препятствующие слиянию пузырьков газа, относятся к стабилизаторам.
Химический состав шлака оказывает большое влияние на поверхностное натяжение. С повышением концентрации закиси железа поверхностное натяжение интенсивно снижается, а плотность повышается от 2700 до 4800 кг/м3.
Ниже приведены данные о плотности и цвете основных составляющих металлургических шлаков:
| Oкисел | Цвет | Плотность, кг/м3 |
| СаО | Белый | |
| Al2O3 | То же | |
| SiO2 | То же | |
| MgO | То же | |
| MnO | Зеленый | |
| FeO | Черный |
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 675; Нарушение авторских прав?; Мы поможем в написании вашей работы!