
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Блиц – тест. Шлак – металлургический, расплав (после затвердевания — камневидное или стекловидное вещество), обычно покрывающий поверхность жидкого металла при
|
|
|
|
Глоссарии
Шлак – металлургический, расплав (после затвердевания — камневидное или стекловидное вещество), обычно покрывающий поверхность жидкого металла при металлургических процессах — плавке сырья, обработке расплавленных промежуточных продуктов и рафинировании металлов. Представляет собой сплав окислов переменного состава; главные компоненты
Вязкость (внутреннее трение) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Основность шлака – это отношение основных оксидов к кислым оксидам.
Кислотность – это отношение кислых шлаков к основным оксидам.
Ион — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом или молекулой одного или нескольких электронов. Ионизация (процесс образования ионов) может происходить при высоких температурах, под воздействием электрического поля.
|
|
- Какова зависимость энтальпии температуры:
A. - ∆Hт° = ∆Н298о - 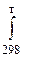 Ср dT
Ср dT
B. - ∆Hт° = ∆Н298о +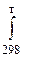 Ср dT
Ср dT
C. - ∆Hт° = ∆Н298о +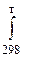 ΔСр dT
ΔСр dT
D. - ∆Hт° = ∆Н298о - 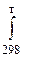 ΔСр dT
ΔСр dT
E. - ∆Hт° = ∆Н298о -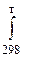 ΔСр dT
ΔСр dT
|
|
|
|
Литература:
- Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
- Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
- Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Лекции№10 «Термодинамические закономерности реакции окисления углерода в кислородсодержащем железе»
План лекции:
1.Распределение кремния, марганца, фосфора и серы между расплавами железа и оксидными расплавами.
2.Межфазное распределение примесей при окислительном рафинировании меди.
Цель лекции:
Ознакомление с закономерностями реакции окисления углерода
Дидактические единицы:
парциальное давление; вакуум; концентрация.
1. Развиваемые представления о кинетике восстановительных процессов тесно связаны с механизмом взаимодействия фаз в условиях кинетической области реагирования, исключающих диффузионные осложнения. Установленные закономерности и теоретические их объяснение опираются на довольно обширные исследования, осуществляемые Г.И. Чуфаровым и его сотрудниками. Значительный опытный материал показывает, что процесс восстановления по своим кинетическим характеристикам существенно отличается от изолированного процесса диссоциации окислов. Он может развиваться в условиях, когда становится невозможной диссоциация. При восстановления действует новая совокупность элементарных звеньев, из которых выпадает звено диссоциации- освобождения от окисла свободного кислорода. В связи с этим отметить, что нецелесообразно сравнивать и противопоставлять восстановление и изолированную диссоциацию.
Кинетические особенности восстановительных процессов с большей или меньшей отчетливостью проявляются на кинетических кривых, полученных для различных окислов. Совокупность кривых, представленных на рис. 1, относится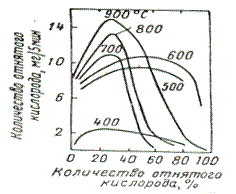 к восстановлению магнетита водородом, но выражает типичную картину развития процесса во времени. Для нее характера ускорение процесса и достижение максимальной скорости при определенной степени восстановления окисла. Затем следует понижение скорости в последующий период довосстановления окисла. Если наблюдать развитие процесса во времени, то при низких температурах можно обнаружить самый начальный индукционный период, предшествующий измеримому возрастания скорости. Такого рода признаки, как и дополнительные исследования состояния твердой фазы, явились основанием для автокаталитической теории, развиваемой Г.И. Чуфаровым с сотрудниками. Восстановительный процесс является топохимическим и сосредоточивается на границе между старой и новой фазами.
к восстановлению магнетита водородом, но выражает типичную картину развития процесса во времени. Для нее характера ускорение процесса и достижение максимальной скорости при определенной степени восстановления окисла. Затем следует понижение скорости в последующий период довосстановления окисла. Если наблюдать развитие процесса во времени, то при низких температурах можно обнаружить самый начальный индукционный период, предшествующий измеримому возрастания скорости. Такого рода признаки, как и дополнительные исследования состояния твердой фазы, явились основанием для автокаталитической теории, развиваемой Г.И. Чуфаровым с сотрудниками. Восстановительный процесс является топохимическим и сосредоточивается на границе между старой и новой фазами.
Рис.1. Кинетические кривые восстановления Fe₂O₃ водородом при различных температурах.
Для него справедливы общие закономерности топохимических реакции, ранее отмеченные для диссоциации окислов. В первом индукционным периоде, только в отдельных активных местах реагирования поверхности окисла происходит к появление зародышей новой фазы. Во втором периоде вокруг зародышей развивается и увеличивается реакционная поверхность, на которой совершаются восстановительные превращения. В результате наблюдается автокатализ – само ускорение процесса.
Сосредоточение реакции на межфазной границе соответствует принципу наибольшей преемственности фаз и облегчает кристаллохимические превращения. В третьем периоде отдельные реакционные зоны сливаются в общую поверхность, которая сокращается по мере ее перемещения в глубь кусочка окисла. В результате наблюдается самозамедление процесса. Такой автокаталитический характер восстановления окислов и соответствующий вид кинетических кривых проявляются при определенных условиях, которые обеспечивают однозональные восстановительные превращения окислов. Одновременное развитие нескольких зон, например, при наложении двух ступеней процесса для окислов железа, искажает картину автокатализа. Имеются и другие причины, связанные с подготовкой поверхности окисла, величиной зерна, природой восстановителя, затрудняющие обнаружение автокатализа. Многозональный механизм проявляется для относительно крупных зерен окисла и при составах восстановительной атмосферы, далеких от равновесия.
В условиях достаточного избытка восстановителя, что характерно для кинетической области реагирования, наблюдается зональность - одновременное осуществление различных ступеней восстановления окислов и послойное распределение их в куске исходного материала согласно диаграмме металл-кислород. Для окислов железа можно обнаружить много зональность при высоких температурах, когда соизмеримы скорости восстановления отдельных окислов.
В самой реакционной зоне восстановительные превращения реагирующих веществ состоят из отдельных звеньев. Молекулы восстановителя адсорбируются на поверхности окисла и ослабляют связь кислорода с металлом:
МеО+СО = МеО·СО адс.
В адсорбционном слое осуществляется химическая реакция
МеО·СО адс = Ме·СО2 адс.
Конденсированная фаза претерпевает кристаллохимические превращения. Поверхностные частицы решетки окисла оказывают ориентирующее воздействие на формирующуюся новую фазу, которая приспособляется к исходной: МеО®Ме.
Завершающей стадией является десорбция газообразного продукта реакции в газовую фазу:
МеО·СО адс = Ме+ СО2 газ.
В сложных многостадийных превращениях скорость всего процесса в целом лимитируется наиболее медленным звеном. В согласии с опытом за медленное звено восстановительного процесса принимаются кристаллохимические превращения или десорбция СО2. Такой адсорбционный механизм процесса отражается в количественных зависимостях. Если количество удаляемого кислорода с одного активного центра поверхности m, а средняя продолжительность существования активного центра Δτ, то скорость процесса при наличии nH ₂ числа активных центров, на которых адсорбируется водород, можно выразить следующим образом:
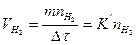
где К¢-константа скорости при определенном давлении водорода. Заполненность поверхности nH 2 определяется изотермой адсорбции. В результате приходим к выражению скорости в зависимости от давления газа-восстановителя:
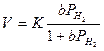 (1)
(1)
которому близко соответствуют опытные данные для начального периода восстановления при постоянной реакционной поверхности и температуре и низком давлении (13,33-26,66 н/м² или 0,1-0,2 мм.рт.ст.) Коэффициент b отражает природу адсорбционного процесса. Для окислов серебра, марганца, железа, никеля, кобальта в тех же условиях и при пониженном давлении экспериментальные данные подчиняются простейшему выражению:
V= К · Рⁿ. (2)
показатель степени n меньше 1 и приближается к ней с повышением температуры. Оба выражения показывают определенную роль изотермы адсорбции.
Поверхность твердого окисла как адсорбента является неоднородной, характеризуется различной поверхностной активностью по отношению к различным компонентам газовой фазы. В зависимости от значения коэффициента адсорбции b проявляется различная наполняемость поверхности частицами реагирующих компонентов. Преимущественное заполнение ее продуктами реакции СО2 и Н2О блокирует активные центры и существенно тормозит восстановительные процессы.
Адсорбируемость частиц различных компонентов может изменятся с изменением давления, температуры и природы реакционной зоны. Опытный материал показывает, что СuO, MnO2, Mn2O3 при прочих равных условиях восстанавливается быстрее СО, чем Н2. Окислы Сu2O, Mn2O3, Fe2O3 водородом скорость процесса выше при высоких температурах, тогда как при восстановлении окисью углерода скорость выше при пониженных температурах. Специальными опытами показано замедляющее влияние двуокиси углерода и водяного пара при восстановлении окислов меди, высших окислов марганца и железа. Это влияние подчиняется соотношению
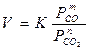
Значения показателя m и n меньше 1, что отражает различную адсорбируемость СО и СО2 на различных участках неоднородной поверхности окисла. При количественной оценке торможения процесса восстановления Fe2O3 водородом в присутствии 7% Н2О найдено, что
δ = 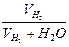
при 700ºС увеличивается в 1,3 раза, при 600ºС-1,5 раза и при 500º-9раз. Отсутствие признаков автокатализа при восстановлении Fe2O3 водородом объясняется адсорбцией водяного пара на активных участках реакционной поверхности.
Влияния температуры изучено в условиях постоянного давления газа-восстановителя (преимущественно при пониженных давлениях) на определенной стадии процесса (обычно-начальной) в области пониженных температур. Ускорение процесса под влиянием температуры подчиняется уравнению

и определяется сравнительно небольшой величиной кажущиеся энергии активации процесса Е. несмотря на значительное различие в свойствах окислов железа, для них получены близкие значения Е при восстановлении водородом:
Е Fe₂O₃=69080 дж/моль
Е Fe₃O₄=56520 дж/моль
Е FeO=58610 дж/моль
Для оценки меди определены величины кажущейся энергии активации в зависимости от природы восстановителя: 44800 дж/моль для Н2 и 56100 дж/моль для СО.
Рассмотренные закономерности могут осложняться дополнительными диффузионными явлениями. Перемещение реакционной зоны в глубь кусочка реагирующего окисла и утолщение слоя образующегося продукта все в большей мере оказывают сопротивление доставке к месту реакции и отводу из нее газообразных участников реакции. При температурах выше 800ºС обнаружено сильное замедление восстановительного процесса для окислов железа. Исследованиями пористости и рентгеноструктурным анализом твердых фаз обнаружено уничтожение ультра и микропор вследствие рекристаллизации и спекания частиц образующегося железа при более высокой температуре.
Диффузионные затруднения усиливаются в условиях, в которых развиваются реальные процессы по мере увеличения размеров кусков окисла и повышения температуры. Процесс перемещается в промежуточную или диффузионную область реагирования в зависимости от сочетания стадий массопереноса и химической реакции.
§ 2. Для более глубокого теоретического суждения о стадиях и звеньях сложного восстановительного процесса необходимо учитывать роль самой твердой фазы. При этом для ионных кристаллов, как отмечалось ранее, следует иметь виду наличие дефектов решетки, принимающих участие в превращениях. Важная стадия адсорбции газа-восстановителя развивается по-разному в зависимости не только от природы газа, но и от природы окисла и разупорядоченности его поверхности, а также избытка на ней кислорода и металла.
Механизм адсорбции и прочность связи газа с адсорбентом оказывается различными для окислов, которые являются дырочным р - проводником с катионными вакансиями или электронным проводником n-типа с катионами в междоузлиях или с вакансиями ионов кислорода. При этом физическая адсорбция переходит в активированную, или хемадсорбцию, которая может быть обратимой или необратимой вследствие внедрения хемадсорбированных ионов в решетку кристалла. Такая хемадсорбция сопровождается передачей электронов от водорода или окиси углерода решетке окисла. В случае окисла с дырочной проводимостью уменьшается концентрация дырок и понижается электропроводность. Для окисла n-типа увеличивается концентрация электронов проводимости и повышается электропроводность. Отсюда выявляется роль электронного обмена в восстановительных процессах и величина электропроводности в связи с интенсивностью их развития. Наряду с этим значительная хемадсорбция приводит к разделению зарядов на поверхности и в объеме окисла, что создает электрическое поле, регулирующее диффузионный перенос ионов в твердой фазе.
Восстановление окислов меди, так же как окислов никеля и железа, развиваются по схеме дырочных проводников р -типа. По Гарнеру, в индукционный период процесса на образование адсорбционных ионов Н⁺ сначала затрачиваются все дырки:
0,5Н2газ+е= Н⁺адс
затем в граничном слое образуется свободные электроны:
0,5Н₂газ= Н⁺адс+е
Электрическое поле в граничных слоях вызывает перемещение ионов меди внутрь кристалла. Процесс восстановленияCu₂O развивается с заимствованием катионных вакансий:
2Н⁺адс+Cu2O+ Cu₂²⁺=Н2Огаз
А затем электронов:
2Н⁺адс+Cu2O+2е= Н₂Огаз +2Cu.
На определенной стадии уменьшения концентрации вакансий ионов около границы Cu2O/Н2 возникают условия образования зародышей меди и их дальнейшего развития:
nCu=(Cu)n
На основе опытного материала предложена схема восстановления магнетита водородом. При действии Н2 с поверхности Fe3O4 отделяются ионы кислорода с образованием Н2О и пленки вюстита FeО:
⅓ Fe3O4+⅓ Н2 = FeО+⅓ Н2Огаз
Хемадсорбция восстановителя на поверхности приводит к образованию ионов Н⁺ с поглащением электронных вакансий:
Н₂газ +2е=2Н⁺адс
Образующиеся ионы Н⁺ взаймодействует с кислородными анионами вюстита с заполнением катионных вакансий:
FeО+2Н⁺адс+Fe²⁺= Н2Огаз
§5. Уменьшение катионных и электронных вакансий и повышение концентрации катионов Fe²⁺ и электронов сопровождается диффузией их через слой FeО ко второй границе – FeО/ Fe3O4. диффузионный перенос осуществляется через катионные и электронные дырки:
Fe²⁺+2е диффузия Fe²⁺+2е
Fe²⁺ и е
На второй границе происходит восстановление трехвалентных ионов железа в
двухвалентные с распространением слоя вюстита внутрь фазы:
Fe3O4=4FeO+.Fe²⁺+2е.
Такой механизм относится к высокотемпературному восстановлению. При пониженных температурах возможно выделение железа на поверхности окисла, через слой которого совершается диффузия кислорода к наружной границе или водорода в противоположном напровлении.
ZnO (как и CdO, NiO2) является примером электронных проводников n-типа. Восстановление начинается с химадсорбции водорода и его ионизации:
0,5Н2газ= Н⁺адс+е
Образующиеся свободные электроны воспринимаются окислом и, в соответствии с опытными измерениями, повышают его электропроводность. Последующее развитие процесса сопровождается удалением кислорода с образованием кислородных вакансий на поверхности:
Н₂газ = Н₂Огаз +О²ֿ+2е
При достаточном накоплении вакансий ионов кислорода протеакет реакция образования ионов цинка в междоузлиях решетки:
Н₂газ+ ZnO= Н₂Огаз+Zn²⁺+2е
Освобаждается ионы цинка и электроны под действием электрического роля перемещаются в граничный слой, где становиться возможным образование и развитие зародышей цинка.
Стадия самой химической реакции тесно связана с особенностями кристаллохимических превращении, и ее кинетические возможности в определенныхсопоставимых условиях можно характеризовать величиной константы скорости К. Диффузионный поток восстановителя преодолевает внешнее сопротивление около поверхности окисла, вызываемое встречным потоком отходящих реакции- СО₂ и Н₂О. Более существенным препятствием является внутреннее сопротивление, которое проявляется при диффузии восстановителя через поры и трещены слоя твердых продуктов реакции. К этому следует добавить и диффузиоонное перемещение ионов металла и кислорода в кристаллической решетке твердых продуктов и совершающиеся в них химические превращения. В очень плотных материалов, в которых диаметр пор меньше длины свободного пробега молекул, диффузионный механизм переноса газа осложняется кнудсеновским молекулярном течением. В противоположность обычной диффузии оно увеличивается с давлением и падает с температурой. Появление тонкой пористости влечет за собой своеобразие кинетических закономерностей восстановительного процесса. При относительно высоких температурах в тончайших каналах может развиваться активированная диффузия под влиянием силового поля частиц на поверхности каналов. Интенсивность такого переноса, связанного с преодалением энергетического барьера, значительно возрастает с повышением температуры.
Обычно перенос восстановителя к реакционной зоне описывают простой газовой диффузией и оценивают эквивалентной величиной эффективного коэффициента диффузии D и толщины покровного слоя δ. При различном сочетании К и D/δ проявляется тормозящее действие различных стадии и восстановительный процесс развивается со своими характерными признаками.
Некоторые из них очевидны на схеме (рис.1), которая показывает рост во времени толщины покровного слоя продукта восстановления х и реакционной зоны, углубляющейся в пределе до середины куска, на расстояние а, при однозональном течении процесса. Диффузионное распределение парциального давления восстановителя в куске материала совершается между величинами давления в исходной фазе Рсо(и) и при равновесии реакции Рсо.
Кинетическая область реагирования характеризуется явным превышением диффузионного переноса над химическим звеном:
D/δ >>К → β >> К
Восстановитель распространяется по всему объему куска окисла. Стадией, тормозящей восстановительный процесс, оказываются кристаллохимические превращения. Такой режим реагирования обнаруживается при относительно низких температурах и для материалов с сильно развитой пористостью или при хорошем их измельчении. В диффузионной области
К>> D/ δ → К >> β
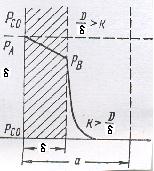
Рис.1. Диффузионно-кинетическая схема восстановления слоя окисла.
и скорость восстановительного процесса определяется относительно медленной стадией диффузии газообразных веществ. Превращения сосредоточиваются в узкой реакционной зоне, где поступающий извне восстановитель полностью расходуется до равновесных давлений. Диффузионный режим восстановительного процесса характерен для высоких температур, малой пористости и значительных размеров кусочков окисла. При высоких температурах возникающие осложнения с диффузией искажает обычные признаки процесса.
В переходной области процесс развивается, когда соизмеримы К и D/ δ и на него оказывает влияние как кинетические, так и диффузионные факторы.
Диффузионно-кинетическая теория восстановительных процессов развивается С.Т.Ростовцевым, который, хотя и с неизбежными допущениями, но в наиболее форме полной мере установил количественные соотношения. Вывод их возможен с некоторыми упрощениями в предложении однозональности процесса, неизменности газопроницаемости реагирующих фаз и реакционной поверхности во времени. Эффективные коэффициенты диффузии D учитывают удельную пористость исходного окисла и продукта его восстановления, а константы К- удельную поверхность пор.
Скорость диффузии определяет перенос восстановителя из газовой фазы к реакционной зоне на единицу поверхности в единицу времени при перепаде давлений РА-РВ, измеренных от уровня равновесного давления Рсо (см.рис.1):
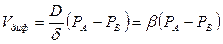 (1)
(1)
в соответствии с данными высокотемпературных опытов принимается, что в каждом элементе реакционной зоне скорость реакции пропорционально давлению:
V´Д = КР (2)
распределение давления газа в реакционной зоне подчиняется закономерностям диффузии, осложненной химической реакцией
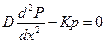 (3)
(3)
После интегрирования уравнения (3) получаем:
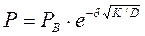 (4)
(4)
Скорость всего восстановительного процесса суммируется из элементарных взаимодействия в реакционной зоне от 0 до а-х:
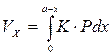 (5)
(5)
Подставляем равенство (4) и интегрируем:
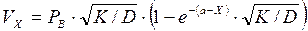 (6)
(6)
при установившемся состоянии процесса выравниваются скорости поступления и расходования восстановителя:
VД = Vх
На этом основании с учетом того, что РА=Рсо/ин – Рсо, совместное решение уравнений (1) и (4) и преобразование приводят к окончательным соотношениям. Время τ, необходимое для достижения определенной степени восстановления, определяется из уравнения
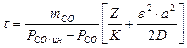 (7)
(7)
Оно связано с расходом восстановителя на единицу объема окисла mCO и с равновесным давлением окиси углерода Рсо, что отражает природу и прочность различных окислов.
Величина Z представляет собой сложную функцию критерия 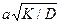
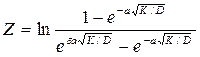 (8)
(8)
Кинетические уравнения отражает ход восстановительного процесса на основе сочетания диффузии и химического превращения. Определенную роль играет критерий:
S = а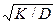 (9)
(9)
в зависимости от которого изменяются характер восстановительного процесса и вид кинетических кривых. При малом его значении (S≤1) достигается кинетическая область реагирования. Она реализуется при изменении размера кусков окисла в зависимости от температурного изменения соотношения К/D. Увеличение размера кусков и их плотности (понижение D) смещает процесс в диффузионную область.
Уточняя некоторые параметры процесса, С.Т.Ростовцев получил более сложные кинетические выражения, но с теми же принципиальными основаниями. Расчеты, произведенные применительно к производственным условиям, позволили представить типичные кинетические кривые, наблюдаемые обычно при экспериментальных исследованиях скорости восстановления железных руд в кусках различного размера. Значительное число исследований, осуществляемых в последнее время, направлено на изучение механизма восстановления различных окислов и кристаллохимических превращений в условиях кинетической области реагирования.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!