
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Блиц-тест
|
|
|
|
Глоссарии
Раствор - гомогенная система, содержащая не менее двух веществ.
Коллоидный раствор - гетерогенная система, состоящая из сплошной фазы, называемой дисперсионной средой и прерывной фазы называемой дисперсной фазой.
Молярная концентрация -число молей растворенного вещества содержащаяся в 1 л раствора.
Мольная доля - безразмерная величина, равная отношению количества молей растворенного вещества к сумме молей всех количеству веществ в растворе.
Массовая доля - отношение массы растворенного вещества к общей массе раствора.
Электролит - вещество, распадающееся в растворе на.ионы.
Электролитическая диссоциация - процесс, распада молекул электролита с образованием положительно и отрицательно заряженных ионов (Например: NaCl - Na+ + Сl–)
Степень диссоциации - отношение числа распавшихся на ионы молекул к общему числу молекул.
Гидролиз - взаимодействие солей с водой, в результате, которого образуются кислота и основание.
Моль - это количество вещества, которое содержит столько же частиц, сколько атомов содержимся в 12 г изотопа углерода С. Число частиц в 1 моле называется постоянной Авогадро Na = 6.023x1023
Молярная масса - масса одного моля вещества.
Обратимая реакция - реакция, которая может идти как в прямом, так и в обратном направлении.
Химическое равновесие - состояние, в котором скорость обратной реакции становится равна скорости прямой реакции.
Катализатор - вещество, изменяющее скорость химической реакции, но остающееся неизменным, после того как реакция закончилась.
1. В термодинамике для описания химических процессов в качестве единицы количества вещества, как правило, используют:
А) джоуль
Б) ампер
В) моль
Г) ом
Д) нет правильных ответов
2.Моль это:
А) количество тепла, которое выделила или поглотила извне система в
результате химической реакции или физического превращения
Б) количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В) внутренняя энергия, которой обладает каждое вещество системы
Г) тепло, поглощенное системой
Д) изменение внутренней энергии систем
3. Термодинамическая система это:
А) самопроизвольный перенос тепла
Б) изменение внутренней энергии системы
В) количество тепла, которое выделила или поглотила извне система в результате химической реакции или физического превращения
Г) внутренняя энергия, которой обладает каждое вещество системы
Д) часть материального мира, отделённая от остального пространства какими-либо естественными границами (например, газ в колбе) или мысленно (выбранная нами совокупность веществ в металлургическом агрегате)
4. В термодинамике принято считать, что если система в ходе процесса выделяет тепло (экзотермический процесс), то:
А) Q<0
Б) Q>0
В) Q=0
Г) нет правильных ответов
Д) все ответы верны
5. Первый закон термодинамики:
А) Н = U+PV
Б) Qр = ∆Н
В) G = Н - TS
Г) ΔН = Н2 – Н1
Д) Q = А + ∆U
6.Уравнеие энтальпии:
А) Н = U+PV
Б) ΔН = Н2 – Н1
В) Qр = ∆Н
Г) G = Н - TS
Д) Q = А + ∆U
7. Под тепловым эффектом понимают:
А) изменение внутренней энергии системы
Б) внутренняя энергия, которой обладает каждое вещество системы
В) самопроизвольный перенос тепла
Г) количество тепла, которое выделила или поглотила извне система в результате химической реакции или физического превращения в расчёте на 1моль участника процесса
Д) часть материального мира, отделённая от остального пространства какими-либо естественными границами (например, газ в колбе) или мысленно (выбранная нами совокупность веществ в металлургическом агрегате)
8. Закон Кирхгофа:
А) 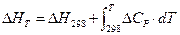
Б) 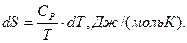
В) ∆G 0T = -RT lnKa
Г) 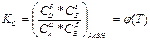
Д) 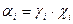
9. Для количественной оценки степени хаотичности вводят специальный термодинамический параметр:
А) Моль
Б) Термодинамическая система
В) тепловой эффект
Г) энтальпия
Д) энтропия
10. Уравнение изотермы химической реакции:
А) ∆GT = ∆G°T + RTIn Пф
Б) ∆ GT = RT(ln Пф - In Ка)
В) ∆G 0T = -RT lnKa
Г) 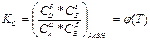
Д) 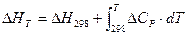
Литература:
- Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
- Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
- Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
- Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
- Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
- Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
- Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
- Симбинова К.Ж. Методические рекомендации по выполнению лабораторных работ. Алма-Ата, 1990, 75 с.
Лекции №12 «Взаимодействие растворенных элементов на основе железа»
План лекции:
1.Межфазные переходы кислорода в системах на основе жидкого железа и меди.
2.Растворимость кислорода, ее зависимость от температуры и состава шлака.
3.Растворимость кислорода в жидких металлах и сложных расплавах. Растворимость кислорода, равновесная с газовыми фазами Н2-Н2О и СО-СО2.
4.Влияние примесей в железе на растворимость кислорода.
Цель лекции:
Ознакомление с основными взаимодействия растворенных элементов на основе железа
Дидактические единицы:
Энтропия; раскисление; константа равновесия; турбулентная диффузия; молекулярная диффузия
фаза; конвертерный газ; аллотропия; катализатор; химическое равновесие; обратимая реакция
молярная масса
1. Сера обладает высокой химической активностью и образует сернистые соединения сульфиды почти со всеми элементами периодической системы Д. И. Менделеева. Сернистые соединения ухудшают многие важные характеристики служебных свойств металлов и сплавов — усиливают склонность к образованию горячих трещин при прокатке и сварке, вызывают:
— повышенную анизотропию свойств,
— уменьшают сопротивляемость коррозии,
— снижают ударную вязкость,
— уменьшают пластические свойства холоднокатанного листа, предназначенного для глубокой и особо сложной вытяжки,
— ухудшают электротехнические свойства стали.
Фосфор так же, как и сера, оказывает в большинстве случаев отрицательное влияние на свойства углеродистых и легированных сталей:
— повышает хрупкость стали,
— увеличивает электросопротивление трансформаторной стали,
— повышает степень ликвации и тем самым увеличивает физическую и химическую неоднородность сталь-ного слитка.
В то же время фосфор увеличивает жидкотекучесть чугуна, что важно для отливки тонкостенных чугунных изделий.
Только для немногих мароксталей фосфор применяется как легирующий элемент, улучшающий чистоту поверхности обрабатываемых на станках деталей. Кроме того, в сочетании с небольшими добавками меди, никеля и хрома фосфор способствует повышению сопротивляемости низколегированных сталй, воздушной и водяяой коррозии.
Возможно более полное удаление серы и фосфора при выплавке стали в агрегатах с основной футеровкой являстся одним из направлений значительного улучшения физико-химичееких и служебных свойств различных марок стали. Особое значение процеес глубокой дефосфорации приобрел в связи с большой потребностью районов нефтяных и газовых месторождений нашей страны в трубной, конструкционной и строительных сталях с весьма малыми допустимыми пределами содержания фосфора, вредное влияние которого на пластичность металла наиболее сильно проявляется в условиях резких колебаниях температур.
§2. В жидком железе сера обладает неограниченной растворимостью. По характеру влияния на растворимость серы в железе элементы разделяются на три группы:
― к первой группе относятся Си, Со сродство которых к сере меньше, чем у железа; они не оказывают существенного влияния на растворимость серы в железе;
― во вторую группу входят Са, Мg, Ва, сульфиды которых более устойчивы, чем FeS; эти элементы способны оказывать на металл десульфурирующее действие;
― третью группу образуют Sі, С, Р, взаимодействующие с железом и образующие с ним те или иные соединения. Введение их в металл снижает концентрацию «свободного» железа, что обусловливает понижение растворимости серы.
Изучение влияния легирующих элементов на коэффициент активности серы в жидком железе при 1600°С показало, что Мn, Сг, Сu, Ni снижают значение этого коэффициента. В наибольшей степени коэффициент активности серы повышают Sі и С.
Путем термодинамического анализа определены количественные соотношения между сульфидами СаS, МпS, МgS и FеS в основном сталеплавильном шлаке. Раесчитывались значения активностей сульфидов металлов, где MeS — СаS, МпS, МgS, FеS. Полученные величины позволили вычислить соотношения а СаS: a (MnS: ажид: атв в шлаке, которые служили критерием распределения серы между сульфидами. В основных сталеплавильных шлаках концентрации СаО, МпО и МgО близки к насыщению. Поэтому активности указанных окислов в дальнейших расчетах приняты равными единице, а активность за-киси железа — 0,2.
В табл. 1 представлены данные о логарифмах констант равновесия реакций десульфурации металла основными окислами. Ниже показано распределение серы между различными сульфидами в основном сталеплавильном шлаке:
| Сульфиды | Температура, оС | |||
| CaS | 70,9 | 72,1 | 72,9 | 73,8 |
| MnS | 23,4 | 21,9 | 20,9 | 19,8 |
| FeS | 5,6 | 5,8 | 5,9 | 6,0 |
| MgS | 0,1 | 0,2 | 0,3 | 0,4 |
| CaS + MnS | 94,3 | 94,0 | 93,8 | 93,6 |
| Всего | 100,0 | 100,0 | 100,0 | 100,0 |
Таблица 1. Логарифмы констант равновесия десульфурации металла основными окислами
| Химические реакции | 
| 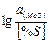
|
| СаОтв+[S]+ [Fe] ↔ CaS+FeOж | 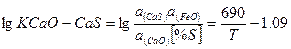
| 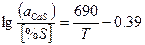
|
| MnOтв+[S]+ [Fe] ↔ MnS+FeOж | 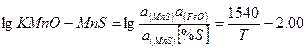
| 
|
| MgOтв+[S]+ [Fe] ↔ MgS+FeOж | 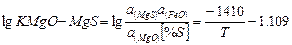
| 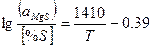
|
| [S]+ [Fe] = (S2-)+(Fe2+) | 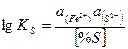
| 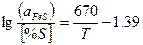
|
Произведенные расчеты показали, что в основных сталеплавильных шлаках~ ~94% серы находится в виде СаS и МnS. Из стальных окислов шлака наиболышей десульфурирующей способностью обладает СаО - окись кальция. Закись марганца - MnO выполняет вспомогательную, но достаточно существенную роль. Окись магния - MgO не обладает свойствами активного десульфуратора.
- Из табл.1 следует, что закись железа – FeO в сталеплавильных шлаках термодинамически препятствует десульфурации, так как сдвигает равновесие в сторону исходных веществ. Из рис.1, на котором показано влияние содержаиия FеО в основном сталеплавильном шлаке на значения коэффициента распределения серы тд= (%3)/[%5], следует, что с понижением содержания FеО в шлаке значения коэффициентов распределения повышаются и что при концентрации окислов железа в мартеновских и конвертерных шлаках (10—20%) изменения коэффициента незначительны.
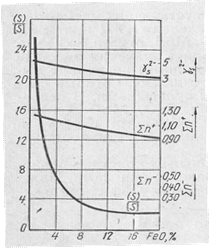
Рис.1. Влияние понижения
содержания FеО в основном сталеплавильном шлаке на значения распределения серы.
Переход серы из металла в шлак происходит на границе соприкосновения металла и шлака по следующим реакциям:
1→ [Fe2+] + [S2-]↔(Fe2+) + (S2-);
2→[Mn2+] + [S2-]↔ (Mn2+) + (S2-)
Если исходить из реакций (1), условием равновесия которой является по II ЗДМ:
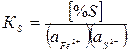 (1)
(1)
то уравнение (1) можно записать в следующем виде:
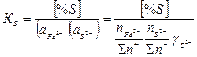 (2)
(2)
Тогда
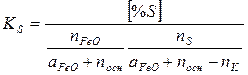 (3)
(3)
откуда
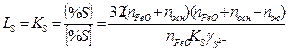 (4)
(4)
где прео, посн, пк — число грамм-молекул закиси железа, основных и кислотных окислов в 100 г шлака; КS — константа равновесия серы; 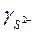 - коэффициент активности серы в шлаке.
- коэффициент активности серы в шлаке.
Значения 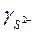 и
и 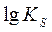 можно определить соответственно из уравнений
можно определить соответственно из уравнений
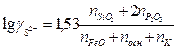 (5)
(5)
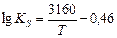 (6)
(6)
В табл. 2. представлены значения Кр и 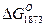 реакций взаимодействия FeS с некоторыми металлами и их окислами. Из данных таблицы следует, что из рассмотренных металлов наибольшим сродством к сере обладает Са, затем следуют А1, Мg, Na, Мn. Для окислов металлов СаО, Nа2О, МnО при взаимодействии с FеS получены отрицательные значения
реакций взаимодействия FeS с некоторыми металлами и их окислами. Из данных таблицы следует, что из рассмотренных металлов наибольшим сродством к сере обладает Са, затем следуют А1, Мg, Na, Мn. Для окислов металлов СаО, Nа2О, МnО при взаимодействии с FеS получены отрицательные значения 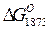 . Окись магния и глиноземы не обладают свойствами специфических десульфураторов, и значения
. Окись магния и глиноземы не обладают свойствами специфических десульфураторов, и значения 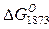 для этих окислов положительные.
для этих окислов положительные.
Таблица 2. Значения Кр и 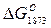 реакций взаимодействия FeS с некоторыми металлами и их окислами
реакций взаимодействия FeS с некоторыми металлами и их окислами
| Химические реакции | lgKp | 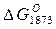 , кДж , кДж
| |
| Хим-й реакции | На один кг металла или окисла | ||
| Взаимодействие с металлами | |||
| Са(г)+FeS(ж)↔CaS(тв)+Fe(ж) | +10,2316 | -367338 | -9173 |
| 2Al(ж)+3FeS(ж)↔Al2S3+3Fe(ж) | +8,0714 | -289790 | -5360 |
| Mg(г)+FeS(ж)↔MgS(тв)+FeS(ж) | +3,1930 | -114638 | -4773 |
| 2Na(суб)+FeS(ж)↔Na2S+3Fe(ж) | +5,9337 | -212670 | -4622 |
| Mn(ж)+FeS(ж)↔MnS(тв)+Fe(ж) | +3,7748 | -135530 | -2462 |
| Взаимодействие с окислами | |||
| СаО(тв)+FeS(ж)↔CaS(тв)+FeО(ж) | +3,4337 | -123280 | -2198 |
| Na2О+FeS(ж)↔Na2S+3FeО(ж) | +3,4431 | -123815 | -1993 |
| MnО(тв)+FeS(ж)↔MnS(тв)+FeО(ж) | +3,3002 | -118490 | -1700 |
| MgО(тв)+FeS(ж)↔MgS(тв)+FeО(ж) | -1,3828 | +1240 |
| Al2О3(тв)+3FeS(ж)↔Al2S3(тв)+ +3FeО(ж) | -8,1611 | +293015 | +2868 |
- Глинозем АІ2O3 в больших или меньших количествах входит в состав шлаков всех сталеплавильных пределов и о его десульфурирующей cпособности существовали различные точки зрения. Для установления влияния окиси алюминия в шлаках сталеплавильных процессов на степень десульфурации стали произведен термодинамический анализ сложной системы, включающей серу, железо и алюминий, а также их окислы и сульфиды.
Из термодинамического анализа следует, что алюминий обладает значительно большим химическим сродством к сере, чем железо, и что алюминий, а не окись алюминия может быть сильным десульфуратором. Об этом свидетельствует большая разность между значениями изобарных потенциалов реакций образования сульфидов алюминия и железа. Вовсем исследованном интервале температур изобарный потенциал реакции 2А1+3FeS=А12S3+ЗFе имеет отрицательные значения, что указывает на возможность самопроизвольного хода процесеа взаимодействия алюминия с FeS.
Алюминий, как и железо, обладает к кислороду бoльшим сродством, чем к сере. Так, величина изобарного потенциала образования А12О3 в два раза численно превышает значеяие ΔG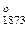 . Отсюда следует, что алюминий может быть эффективно использован как десульфуратор при отсутствии в системе кислорода или при значительном избытке алюминия, когда весь необходимый для раcкисления металла алюминий сначала будет расходоваться на процесс раскисления, а затем выполнять роль дeсульфуратора.
. Отсюда следует, что алюминий может быть эффективно использован как десульфуратор при отсутствии в системе кислорода или при значительном избытке алюминия, когда весь необходимый для раcкисления металла алюминий сначала будет расходоваться на процесс раскисления, а затем выполнять роль дeсульфуратора.
- При очень высоких температурах порядка 2300—2400K, и наличии в шлаке твердого углерода (коксик, входящий в состав раскислительной смеси воостановительного периода электроплавки) окись алюминия может восстанавливаться до металлического алюминия по реакции А12О3+ЗС— 2А1+ЗСО и тогда последний может оказаться десульфуратором.
Что же касается окиси углерода, входящей в состав восстановительной атмосферы электропечей, то, установлено что она не может восстанавливать А12О3 ни при каких доступных в металлургии температурах. Таким образом, термодинамический анализ показал, что глинозем нельзя использовать как самостоятельный десульфуратор стали.
- Фтористый кальций ускоряет процесс шлакообразования и повышает жидкотекучесть шлака, поэтому он нашел широкое применение в металлургии. Считается, что с увеличением содержания СаF2 в шлаке повышается его основность и возрастает количество удаленной из металла серы. Вместе с тем по экспериментальным данным электропечные шлаки с повышенным содержанием фтористого кальция (более 3%) обладают пониженной десульфурирующей способностью.
Коэффициент распределения серы между шлаком и металлом
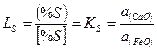
где a (СаО) и а (FeO) — активность СаО и FеО в шлаке.
Для разжижения основных рафинировочных шлаков рекомендуется применять разжижающие добавки, которые не повышают активности закиси железа (шамот, глинозем).
Возможность протекания реакции
CaF2 + FeS = CaS + FeF2
экспериментально изучалась методом рентгеноструктурного анализа. Смесь химически чистых компонентов (50%СаF2 и 50% FеS) нагревалась в печи с графитовым нагревателем в атмосфере аргона и после выдержки в течение 30 мин при температуре 1800К. сбрасывалаеь в сосуд с жидким азотом. После закалки и охлаждения образцы тщательно измельчались и подвергались рентгено-структурному анализу, который показал, что при 1800K реакция не получала заметного развития.
§3. Изучению механизма и кинетических закономерностей процееса десульфурации посвящено большое число исследований. Несмотря на это, по ряду важных вопросов нет единой точки зрения. М.М.Карнаухов механизм процесса десульфурации представлял состоящим из двух стадий:
- перераспределение сульфидов железа и марганца между металлом и шлаком;
- последующее взаимодействие сульфидов железа и марганца с окисью кальция шлака.
Исходя из молекулярной теории строения шлаков, механизм процесса десульфурации чугуна представляется в таком виде:
- первая стадия—переход из металла в шлак молекул
сульфида железа;
- вторая стадия — гомогенная реакция в шлаке между сульфидом железа и окисью кальция;
- третья стадия — окисление углерода, растворенного в чугуне, закисью железа шлака.
В соответствии с современными представлениями: о строении расплавленных металлов и шлаков принимается, что переход серы из металла в шлак происходит на границе соприкосновения металла и шлака.
Измерения активности проб металла показали, что десульфурация кислым шлаком сопровождалась одновременным переходом серы и железа в шлак. Переход для значительно больших количеств серы в основной и нейтральный шлаки не сопровождался увеличением содержания в них железа. На основании результатов исследований принималось, что взаимодействие серы с основным и нейтральным шлаками протекает, повидимому, по реакции 11, а с кислым — по реакции 12 (см. табл. 1).
В большинстве работ принимается, что сера в основном сталеплавильном шлаке находится в виде анионов S2~ и частично S024~
Таблица 1.
Различные схемы механизма десульфурации железоуглеродистых сплавов
| Cхема | Схема механизма десульфурации | Уравнения | Авторы |
| СаО(шл)+FeS(м)↔CaS(шл)+FeO(шл) | Осанн | ||
| FeS(м)↔ FeS(шл) MnS(м)↔ MnS(шл) СаО(шл)+FeS(шл)↔CaS(шл)+FeO(шл) СаО(шл)+MnS(шл)↔MnS(шл)+MnO(шл) | Карнаухов | ||
| FeS(м)↔ FeS(шл) СаО(шл)+FeS(шл)↔CaS(шл)+FeO(шл) FeO(шл)+C(м)↔CO(r)+Fe(м) | Чанг и Гольдман | ||
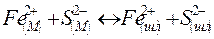
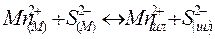
| Левин и Борнацкий | ||
S(м)+О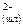 ↔ S ↔ S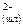 +О(м)
для основного шлака
FeS(м)+S(м)↔Fe +О(м)
для основного шлака
FeS(м)+S(м)↔Fe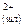 +S +S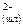 для кислого шлака
для кислого шлака
| Есин и Шихов | ||
FeS(м)↔Fe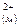 +S +S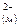 a) FeS(м)↔ FeS(шл)
б) Fe
a) FeS(м)↔ FeS(шл)
б) Fe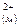 +S +S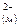 ↔ Fe ↔ Fe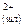 +S +S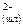
| Борнадский |
Количественные соотношения между ними определяются кислородным потенциалом газовой фазы. Сера в металле, по-видимому, находится в виде неустойчивых комплексов FeS и частично в виде анионов S2-~. Можно предположить, что в металлической ванне протекает реакция 13. Вероятность протекания реакции (13) существенно возрастает в слоях металла, соп.рикасающихся со шлаком, в котором сера в большей доле, чем в металле, находится в анионной форме S2-~.
Таблица 2. Основные показатели десульфурации металла в доменных, электросталеплавильных, мартеновских печах и кислородных конвертерах
| Про цесc | Среднее содержание серы в шихтовых материалах, % | Количество шлака к массе металла, % | Основ Ность шлака | Содержание FeО в шлаке, % | Температура металла на выпуске, оС | Содержание серы в шлаке, % | Содержание серы в металле, % | Коэффициент распределения серы | Степень удаления серы в шлаковую и газовую фазы ∆S,% |
| Доменный | 0,45-0,55 | 55-65 | 1,20-1,25 | 0,3-0,5 | 1400-1450 | 1,0-2,5 | 0,030-0,035 | 30-85 | 94-96 |
| Электросталеплавильный | 0,03 | 4-6 | 2,7-3,2 | 0,3-0,8 | 1620-1640 | 0,20-0,30 | 0,005-0,010 | 20-60 | 71-87 |
| Кислородно-конвертерный | 0,040-0,045 | 12-14 | 2,5-3,3 | 12-18 | 1610-1630 | 0,10-0,2 | 0,018-0,023 | 4-10 | 45-60 |
| Мартеновский | 0,040-0,045 | 16-20 | 2,5-3,0 | 10-20 | 1600-1620 | 0,06-0,10 | 0,020-0,025 | 3-5 | 40-55 |
Из табл. 2. в которой приведены сравнительные данные основных показателей десульфурации металла в доменных, электросталеплавильных, мартеновских печах и кислородных конвертерах, следует, что наиболее благоприятные условия для удаления серы существуют в доменных и электросталеплавильных печах. Так, для доменных печей коэффициент распределения серы составляет 30—85, а степень удаления серы в шлаковую и газовую фазы — 94—96 %. Успешному удалению серы при доменном процеосе способствуют низкая концентрация закиси железа (0,3—• 0,5%) и большие значения коэффициента активности серы в чугуне.
По содержанию закиси железа в конечных шлаках электросталеплавильный процесс близок к доменному. Шлаки кислородно-конвертерного и мартеновского процессов характеризуются высоким содержанием FeО (10—20%). Наиболее низкие значения LS присущи мартеновскому процессу.
По характеру изменения содержания серы в металле плавку можно разделить на три периода:
- снижение cодержания серы (с начала продувки до 10 мин),
- ресульфурация (с 10 до 15 мин),
- активный процесс десульфурации металла (с 15 мин до конца продувки, оcобенно в последние 5 мин).
Десульфурация ванны в первом периоде связана с понижением содержания марганца в чугуне от 1,0—1,2 до 0,20—0,35% и повышением концентрации закиси марганца в шлаке до 22—25%.
- Константа равновесия Кр и изобарный потенциал ∆G реакций окисления марганца и его взаимодействия с серой при 1523 К (содержание серы в чугуне 0,05%, концентрация марганца в расплаве 1% и парциальное давление 101,3 кПа) имеют следующ,ие значе-ния:
16. [Mn]+(FeO)ж ↔MnO(тв)+Feж +3,2446-90760
17. [Mn]+1/2 O2(г) ↔MnO(тв) +8,7550-256600
18. [Mn]+FeSж ↔MnS(тв)+Feж +4,2646-120600
19. [Mn]+[S] ↔MnS(тв) +5,7914-169500
Из сопоставления значений ∆G реакций окисления MnO2 и FeO 16 - 19 следует, что при окислении марганца в результате его взаимодействия с серой протекает и десульфурация ванны. Относительно низкая температура жидкого чугуна и в особенности ее снижение на 50— 100°С при заливке на холодный железостальной лом способствует более активному протеканию реакций образования сульфида Mn 18 и 19.
К моменту, когда окислится основное количество марганца, возможны не только замедление или прекращение десульфурации ванны, но при определенных условиях даже ресульфурация. К середине конвертерной плавки увеличение содержания окиси кальция в шлаке при одновременном снижении концентрации закиси железа приводит к насыщению его окисью кальция, в результате чего шлак попадает в двухфазную область, при этом начинается выпадение мелких кристаллов окиси кальция и ортосиликата кальция. В конвертере появляется так называемый «сухой» шлак, основность жидкой части шлака. понижается, что приводит к перераспределению серы между металлом и шлаком, т.е. к возможной ресульфурации.
С увеличением содержания марганца в чугуне во все периоды плавки значения LS растут. Аналогично содержанию марганца в металле на коэффициент распределения серы влияет и концентрация закиси марганца в шлаке, причем положительное влияние закиси марганца на процесс десульфурации наблюдается во все периоды продувки.
Повышение температуры металлической ванны в течение 15 мин от начала продувки препятствует развитию десульфурации марганца по реакциям 16 и 19, в результате чего значения LS понижаются. В третий период, когда концентрация марганца сравнительно невелика, а температура металла высокая, на десульфурацию металла влияет в основном окись кальция. Закись марганца продолжает, помимо прямого, оказывать косвенное влияние на десульфурацию металла, так как способствует ускорению растворения извести и повышению эффективной основности шлака. Поэтому после 20 мин продувки значения LS с повышением температуры увеличиваются.
- Термодинамически закись железа в основном сталеплавильном шлаке препятствует, а кинетически —способствует десульфурации металлической ванны, так как ускоряет растворение извести в шлаке и по аналогии с закисью марганца повышает эффективную основность шлака. В условиях конвертерного процесса после 5 и 10 мин продувки, когда основность шлака еще недостаточная, закись железа оказывает отрицательное влияние на процесс десульфурации. Положительное влияние начинает проявляться после 15 мин продувки, когда шлак становится достаточно гомогенным (однородным).
Любому отрезку времени по ходу конвертерного процесса отвечает оптимальная основность шлака. Так, 5; 10; 15; 20; 25 мин после начала продувки соответствуют следующие значения оптимальной основности шлака: 1,3; 1,7; 2,4; 2,8; 3,2. В процессе продувки более низкая или высокая основность шлака по сравнению с оптимальной сопровождается снижением значений LS. При основности шлака выше оптимальной снижение значений LS обусловлено повышенной вязкостью шлакового расплава.
4. Известны четыре химических соединения железа с фосфором: Fе3Р, Fе2Р, FеР и FеР2. Для металлургии значительный интерес представляют Fе3Р и Fе2Р. Из диаграммы состояния системы Fе — Р, cледует, что фосфид Fе3Р плавится инконгруэнтно и разрушается при температуре 1166°С, поэтому он не может существовать в жидкой стали. В растворах фосфора в жидком железе наблюдаются значительные отрицательные отклонения от закона Рауля. В указанных растворах, повиди-мому, стойко сохраняются атомные группировоки, отвечающие плавящемуся конгруэнтно при 1365°С фосфиду Fе2Р. Таким образом, в жидком чугуне и стали фосфор находится в виде Fе2Р.
Окисление фосфора протекает на границе металл — шлак, так как содержание кислорода в объеме металла в присутствии углерода ниже равновесного с фосфором.
Реакция окисления фосфора характеризуется следующими стадиями: на границе раздела шлак — металл 5(FеО) =5[Fе]-5[О];
в прилегающих к шлаку слоях металла
1. 2[Fe2P]+5[O]=(P2O5)+4Fe
прилегающем к металлу слое шлака
2. 4(CaO)+(P2O5)=(4CaO·P2O5);
3. 3[Fe2P]+5(FeO)+(CaO)=4CaO·P2O5+9[Fe]
Константа равновесия реакции 3 и равновесное содержание фосфора в металле определяются формулами
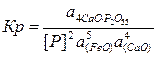 (1)
(1)
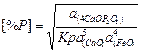 (2)
(2)
Из уравнения (2) следует, что окислению фосфора и его удалению из металла способствуют:
- увеличение активности закиси железа (а FeO) в результате дополнительной присадки железной руды, окалины или более интенсивная продувка ванны кислородом при увеличении расстояния фурм от уровня металла;
-- повышение активности окиси кальция (а CaO) или концентрации свободной окиси кальция дополнительными присадками извести, брикетов и других материалов, содержащих окись кальция;
-- уменьшение активности фосфата кальция в результате скачивания шлака и последующей его наводки присадкой извести, боксита, железной руды;
-- понижение температуры ванны (так как при этом значения Кр возрастают). Такой вывод о влиянии температуры на снижение содержания фосфора в металле является правильным с точки зрения термодинамики. Вместе с тем при высоких температурах быстрее наводится достаточно основной и окислительный шлак, что обеспечивает ускоренную и более глубокую так называемую «горячую» дефосфорацию.
Константу равновесного распределения фосфора между шлаком и металлом можно представить в виде уравнения
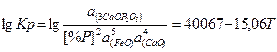 (3)
(3)
Так как в составе сталеплавильных шлаков имеются основные окислы СаО, МnО, МgО, FеО, представляет интерес сопоставить теплоты образования соответствующих фосфатов.
| Соединения | 3FeO·P2O5 | 3MnO·P2O5 | 3MgO·P2O5 | 3CaO·P2O5 | 4CaO·P2O5 |
| Теплота образования, кДж |
Дефосфорация металла протекает с достаточно большими скоростями как в лабораторных, так и в производственных условиях. Равновесие устанавливается в течение 10—15 мин. Эта особенность вносит известные затруднения в изучение кинетики распределения фосфора между шлаковой и металлической фазами. Для того чтобы замедлить переход фосфора из металла в шлак и с большей достоверностью проводилась изучении кинетики процесса дефосфорации.
Опыты проводились в электропечи с угольным сопротивлением при 1550—1700°С в атмосфере азота. После расплавления навесок металла и шлака и установления необходимой температуры в металл задавались присадки феррофосфора (0,01 г), ме-ченого изотопом 32Р. С повышением концентрации фосфора средняя скорость его перехода в шлак возрастала и со-кращалось время установления равновесия: для 0,1; 0,05; 0,015; 0,004% Р — соответственно на 10, 240; 420; 540 с. Эти данные указывают на то, что процесс обесфосфоривания в выбранных условиях протекает в кинетической области, и течение его контролируется скоростью химической реакции, а не конвективной диффузией фосфора в металле или шлаке.
Исследованиями также установлено, что изменение толщины слоя шлака в два раза не влияет на скорость перехода фосфора из металла в шлак. Отбор проб по высоте шлака показал, что все они имеют одинаковую концентрацию 32Р. Замена окислов железа окисью кальция ускоряет процесс дефосфорации, в то время как повышение содержания в шлаке SіО2 или А12О3 замедляет зтот переход. При увеличении содержания в шлаке МgО и одновременном уменьшении концентрации ҒеО (до известного предела) не наблюдалось изменения скорости удаления фосфора.
Тримолекулярные реакции типа 3 маловероятны. Сложная реакция обесфосфоривания не могла протекать достаточно быстро, если бы не состояла из ряда промежуточных стадий. Предположителю ее можно представить совокупностью стадий адсорбции ионов кислорода и последующего окисления фосфора на поверхности раздела фаз:
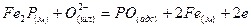
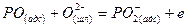
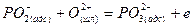
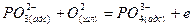
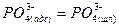

Компенсация зарядов осуществляется в результате перехода ионов железа из шлака в металл: 2,5Fе2++5е~=2,5Fе(М).
После обработки имеющихся литературных данных о распределении фосфора между шлаком и металлом была получена следующая формула для расчета значений lg Lp:

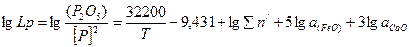 (3)
(3)
Для шлаков с повышенной основностью принято приближенно, что окись магния равноценна окиси кальция и кремнезем, пятиокись фосфора, глинозем, окись хрома, окись железа полностью связаны в виде соединений 2СаО.SіО2; ЗСаО • Р2О5; СаО • А12О3; СаО • Fе2О3. В соответствии с этим основность шлака определяется по формуле:
 (4)
(4)
Достаточно глубокая дефосфорация и десульфурация металла достигается вдуванием в металлическую ванну порошкообразных шлакообразующих материалов. Наилучшие результаты по дефосфорации были получены при использовании смеси порошков из:
- 65% извести,
- 25% железной руды,
- 10% плавикового шпата.
Глубина процесса дефосфорации при вдувании порошкообразной смеси зависит от химического состава и температуры металла. Наиболее полно осуществляется дефосфорация металла при содержании в нем 0,25—0,30% хрома: концентрация фосфора в металле снижается до 0,002% и ниже и не зависит от исходного содержания фосфора в металле.
После вдувания смеси порошков в металлическую ванну с содержанием 0,8—1,2% хрома концентрация фосфора составляла 0,004—0,010%, она возрастала с увеличением исходного содержания фосфора в металле. Ухудшение процесса дефосфорации металла с 0,8—1,2% хрома связано с окислением хрома и повышением вязкости формирующегося шлака при вдувании смеси порошков. Внедрение разработанной технологии обеспечило получение устойчивого низкого содержания фосфора (не более 0,005%) в готовом металле при суммарном содержании фосфора и серы не более 0,010% каждого.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 560; Нарушение авторских прав?; Мы поможем в написании вашей работы!