
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометрическое титрование
|
|
|
|
Определение произведения растворимости (ПР) труднорастворимых соединений (электролитов).
Константа диссоциации электролита
Степень диссоциации электролитов
ПРИМЕНЕНИЕ КОНДУКТОМЕТРИИ
При помощи кондуктометрии можно определять ряд физико-химических величин электролитов:
a = 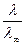 .
.
К = 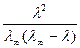 С.
С.
Из закона действующих масс следует, что для насыщенного раствора сильного электролита Кm Аn:
KmAn = mK+ + n A-
можно написать
[K+]m[A-]n = k[KmAn] = ПР.
В случае бинарного электролита, диссоциированного нацело
[K+] = [A-] = 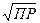 = С,
= С,
где С - растворимость данной соли в моль/л.
Измеряют электропроводность раствора, находящегося в равновесии с осадком малорастворимого сильного электролита. Зная подвижность ионов l+¥ и l-¥, на которые диссоциирует труднорастворимая соль в сильноразбавленном растворе, и, определив экспериментально удельную электропроводность À раствора, можно вычислить растворимость электролита.
С = 1000;
С = 1000(À-ÀН2О)/(l+¥+l-).
Этот метод позволяет определить эквивалентную точку при титровании
по измерению электропроводности. Изменение электропроводности при кондуктометрическом титровании связано с тем, что в ходе реакции образуются малодиссоциированные или малорастворимые соединения. Чувствительность кондуктометрического титрования зависит от разности в подвижностях связываемых и появляющихся ионов, причем она будет тем выше, чем больше эта разница. В связи с тем, что подвижность ионов Н+ и ОН- значительно превышают подвижности других ионов, кондуктометрическое титрование наиболее целесообразно применять для кислотно-основного титрования
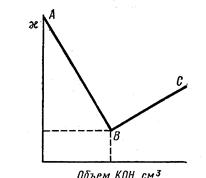
На рисунке показано изменение удельной электропроводности при титровании раствора сильной кислоты раствором сильного основания, например, соляной кислоты раствором КОН по реакции
|
|
|
HCl + KOH = KCl + H2O,
или в ионной форме
H+ + Cl- + K+ + OH- = H2O + K+ + Cl-.
В результате более подвижные ноны водорода замещаются менее
подвижными ионами калия. По достижении эквивалентной (нейтральной) точки В, где электропроводность раствора имеет минимальное значение, снова наступает увеличение электропроводности, так как в раствор дополнительно продолжают поступать ионы калия и гидроксила.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 465; Нарушение авторских прав?; Мы поможем в написании вашей работы!