
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциал его определяемся соотношением
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД
Если металлический электрод покрыть слоем малорастворимой соли, этого металла и опустить в раствор хорошо растворимой соли, содержащей тот же анион, то такой электрод работает обратимо относительно этого аниона. К таким электродам принадлежит каломельный электрод.

В нем паста из ртути и каломели (Hg2Cl2) помещается в раствор KCl (обычно 1н или насыщенный).
Процесс отвечает записи
Cl- (aCl-) ½Hg2Cl2, Hg.
На электроде протекает реакция
2Hg + 2Cl- = Hg2Cl2 + 2e.
j = j0кал – lnaCl-.
Он является, таким образом, хлорным электродом, в котором ионы хлора поступают не от газообразного Cl2 а от твердого хлорида ртути. Потенциал этого электрода по нормальному водородному электроду при 25°С при 1н растворе =+0,2819 в.
Ввиду вредности работы с ртутью в последние годы шире применяют аналогичный каломельному - хлорсеребряный электрод.
ИЗМЕРЕНИЕ ЭДС. НОРМАЛЬНЫЙ ЭЛЕМЕНТ
При работе гальванического элемента его ЭДС не сохраняет строго постоянного значения вследствие изменения концентрации растворов и других причин. Поэтому точные измерения ЭДС должны производиться при минимальном прохождении тока. Этому отвечает компенсационный метод измерения ЭДС, дающий возможность определить ЭДС элемента путем измерения разности потенциалов в условиях обратимой работы элемента.

Источник тока 1 с известной ЭДС, например, аккуммулятор, замкнут через проволоку АВ. Проволока должна обладать одинаковым сопротивлением по всей длине. При этом условии падение напряжения на всем протяжении ее от А до В пропорционально длине проволоки. Проволока натянута вдоль шкалы. В боковую цепь включены последовательно измеряемый элемент 2 и чувствительный гальванометр 3. Перемещая подвижный контакт К, можно подобрать такое расположение его, при котором ЭДС элемента будет точно компенсироваться и в боковой цепи ток проходить не будет. Это означает, что падение потенциала вдоль проволоки на участке АК будет точно равно ЭДС измеряемого элемента Е. Зная длину n этого участка проволоки АК, длину m остальной части КБ и ЭДС источника 1,равную Е1, можно определить
Е2 = Е1  .
.
При измерениях ЭДС часто возникает необходимость иметь вспомогательный элемент с хорошо известной и устойчивой ЭДС.Для этой цели применяют так называемый нормальный элемент (элемент Вестона).
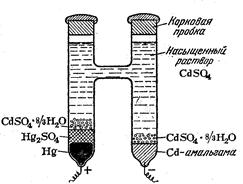
В нем отрицательный электрод представляет собой амальгаму кадмия, помещенную в раствор сульфата кадмия, насыщенный относительно кристаллогидрата CdSO4 ×H2O и находящийся в постоянном соприкосновении с ним, положительный электрод представляет пасту из ртути и Hg2SO4, помещенную в тот же раствор, насыщенный относительно CdSO4 ×H2O. Для лучшего контакта с вводом под пасту помещается некоторое количество ртути. Положительный электрод в этом элементе подобен каломельному, но работает обратимо в отношении ионов SO42-. Отрицательный электрод принадлежит к амальгамным электродам.
При работе этого элемента протекает реакция
Cd + Hg2SO4 + H2O = CdSO4× H2O + 2Hg.
При кратковременном замыкании, например, в случае применения элемента для компенсационных целей, он работает вполне обратимо и устойчиво. Последнее обусловлено тем, что оба электрода находятся в насыщенном растворе.
При 20°C его ЭДС Е = 1,01830 в.
|
|
Дата добавления: 2014-01-05; Просмотров: 376; Нарушение авторских прав?; Мы поможем в написании вашей работы!