
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесия в растворах координационных соединении
|
|
|
|
Поскольку ионы в водном растворе гидратированы (в неводном— сольватированы), уравнение реакции образования комплексного соединения в растворе имеет вид:
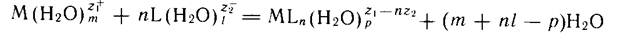
Однако эта схема громоздка. Для удобства уравнение реакции комплексообразования обычно записывают в более простом виде:
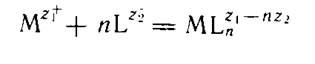
имея в виду, что участники реакции гидратированы (сольватированы).
Опуская для простоты заряды ионов, получаем простую схему реакции комплексообразования в растворе:
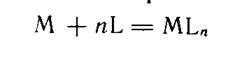
В качестве лигандов выступают не только ионы, но и нейтральные молекулы (аммиак, амины, тиомочевина и др.).
Константа равновесия реакции комплексообразования называется константой устойчивости комплексного соединения:
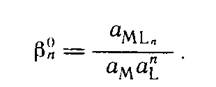
Процесс образования и диссоциации комплексного соединения в действительности протекает ступенчато:

называют ступенчатыми константами устойчивости в отличие от общей или суммарной константы устойчивости. Ступенчатые константы устойчивости связаны с общей простым соотношением:
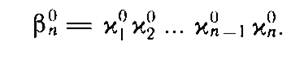
Величину, обратную константе устойчивости, называют константой нестойкости и, соответственно, ступенчатой константой нестойкости.
Учитывая связь активности частицы с ее концентрацией, можно записать:

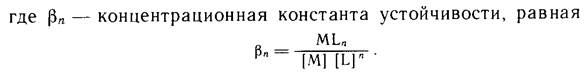
Зависимость коэффициента активности от ионной силы раствора передается известным уравнением. Поэтому можно записать:
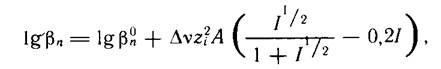
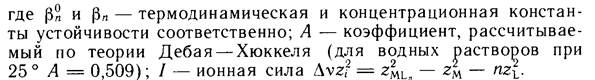
Чем выше заряды реагирующих частиц, тем больше эффект ионной силы. Область применимости выше приведенного уравнения ограничивается растворами с ионной силой 0.7...0.8. При более высоких значениях ионной силы константы устойчивости с ростом ионной силы начинают возрастать.
В растворах с постоянной ионной силой концентрационные константы устойчивости сохраняют постоянство, что позволяет рассчитывать в растворах непосредственно равновесные концентрации.
Для нахождения констант устойчивости обычно используют специальные функции, легко вычисляемые из опытных данных и связанные простыми математическими зависимостями с константами устойчивости. Широкое распространение, в частности, получила «функция образования» n, предложенная Я- Бьеррумом:

где cLo и cMo, — общие концентрации лиганда и иона металла-ком- плексообразователя (центрального иона) соответственно: [L] — равновесная концентрация лиганда.
Функция образования n представляет собой отношение концентрации лиганда, связанного в комплекс или комплексы, к общей концентрации иона металла-комплексообразователя. По физическому смыслу функция образования является своеобразным средним координационным числом и может изменяться от нуля, когда в растворе нет комплексообразования, до предельного максимального значения координационного числа.
Существует несколько методов расчета констант устойчивости по функции образования и другим экспериментальным данным. Наиболее точными являются распространенные в последнее время машинные методы расчета, основанные на статистическом принципе максимального правдоподобия.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 666; Нарушение авторских прав?; Мы поможем в написании вашей работы!