
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод електронного балансу
|
|
|
|
Процеси окиснення завжди супроводжуються процесами відновлення. Один процес не може відбуватися без другого, оскільки вони пов'язані лише з переміщенням матеріальних частинок — електронів, а не з їх знищенням або створенням. Тому в рівняннях окисно-відновних реакцій потрібно зрівнювати кількості відданих і приєднаних електронів відповідними коефіцієнтами.
Складаючи рівняння окисно-відновних реакцій, насамперед, слід визначити ступені окиснення кожного з елементів, що входить до складу вихідних речовин і продуктів реакції, а потім зазначити ті атоми або йони, ступінь окиснення яких змінюється, зазначити окисник і відновник (а в разі потреби і середовище). Після цього потрібно підібрати коефіцієнти в рівнянні реакції, пам'ятаючи, що загальне число відданих електронів повинно дорівнювати загальному числу приєднаних.
Простим прикладом окисно-відновної реакції може бути взаємодія сірководню з бромною водою, внаслідок якої утворюються вільна сірка і бромо-водень. Спочатку записують схему рівняння реакції

Потім визначають ступені окиснення атомів елементів до реакції і після неї; ступені окиснення змінюються у Брому і Сульфуру:

Ступінь окиснення Сульфуру змінюється від -2 до 0:
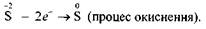
Процес віддавання електронів, що супроводжується підвищенням ступеня окиснення елемента, називається окисненням.
Електрони, які віддає Сульфур, приєднуються до атомів Брому, ступінь окиснення Брому в цьому разі змінюється від 0 до -1:

Процес приєднання електронів, що супроводжується зниженням ступеня окиснення елемента, називається відновленням.
Наступний етап — підбирання стехіометричних коефіцієнтів для сполук, атоми яких змінюють ступені окиснення. Для цієї реакції баланс «електронного обміну» такий:
|
|
|

Враховуючи те, що кількість відданих відновником електронів повинна дорівнювати кількості електронів, приєднаних окисником, знаходять спільний множник для двох електронно-іонних рівнянь. У цьому разі таким спільним множником буде 2. Отже, з однією молекулою Н28 реагує одна молекула брому.
Знайдені коефіцієнти підставляють у схему рівняння реакції і стрілку замінюють на знак дорівнює:

Розглянуте рівняння реакції є найпростішим прикладом окисно-відновного процесу. Ознайомимось із складнішими окисно-відновними процесами. Під час взаємодії перманганату калію з йодидом калію за наявності сульфатної кислоти малиновий розчин знебарвлюється і виділяється вільний йод. Ця реакція відбувається за схемою

Встановлюємо, що ступінь окиснення Мангану змінився від +7 до +2, а Йоду — від -1 до 0, тобто Манган відновився (перманганат калію — окисник), а Йод — окиснився (йодид калію — відновник).
Щоб розрахувати коефіцієнти перед окисником і відновником, потрібно скласти рівняння електронного балансу:

Враховуючи те. що кількість електронів, відданих Йодом, повинна дорівнювати кількості електронів, приєднаних Манганом, знаходимо спільний множник для цих двох рівнянь. Ця рівність буде дотримана в тому разі, коли 10 йодид-іонів віддадуть 10 електронів, а два йони Мангану приєднають їх:
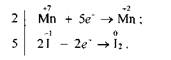
Отже, множники 2 і 5 є коефіцієнтами відповідно біля йонів Мангану та Йоду в рівнянні окисно-відновної реакції. Ці коефіцієнти проставляємо в молекулярному рівнянні біля відповідних сполук як основні. Розглянуту реакцію можна записати так:

І, нарешті, визначимо другорядні коефіцієнти, тобто ті, що повинні стояти біля формул сполук елементів, які не змінюють своїх ступенів окиснення. Потрібно зрівняти кількості йонів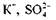 та атомів Оксигену. Сульфат-іони зв'язують не тільки йони
та атомів Оксигену. Сульфат-іони зв'язують не тільки йони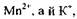 а йони Гідрогену — вісім атомів Окси-
а йони Гідрогену — вісім атомів Окси-
|
|
|
гену. Отже, рівняння матиме такий остаточний вигляд:

Для складання рівнянь окисно-відновних реакцій також застосовують йонно-електронний метод. Так, для розглянутої вище реакції йонно-електрон-ні рівняння матимуть вигляд:
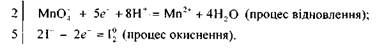
Перше рівняння процесу («напівреакція») — відновлення перманганат-іона — показує, що під час перетворення йона МпО; на катіон Мп2* повинні зв'язатися чотири атоми Оксигену з утворенням чотирьох молекул води. Для цього і потрібно вісім йонів Гідрогену. Друге рівняння процесу («напівреакція») — окиснення Йоду — показує, що цей процес відбувається без участі. йонів Гідрогену.
Знайшовши спільний множник для цих двох йонно-електронних рівнянь (двох «напівреакцій»), додають рівняння процесів відновлення й окиснення, враховуючи множники 2 і 5, і дістають сумарне йонне рівняння даної окисно-відновної реакції:

Це рівняння реакції можна подати також і в молекулярному вигляді:
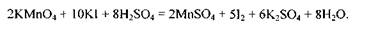
Отже, під час складання рівнянь окисно-відновних реакцій слід дотримуватись послідовності дій, наведених нижче.
1. Скласти схему рівняння реакції і зазначити вихідні речовини і продукти
реакції.
2. Визначити ступені окиснення елементів, що входять до складу сполук у
лівій і правій частинах схеми рівняння; виділити елементи, ступені окиснення яких змінюються.
3. Скласти йонно-електронні рівняння напівреакцій окиснення і відновлен
ня; підібрати коефіцієнти до окисника і відновника для двох напівреакцій,
зрівнюючи кількості відданих і приєднаних електронів.
4. Додати рівняння процесів окиснення і відновлення з урахуванням
підібраних коефіцієнтів.
На процес окислення — відновлення значною мірою впливають концентрації окисника і відновника. Із збільшенням концентрації окисника або зменшенням концентрації відновника окиснювальна здатність окисника зростає.
Можливість і характер перебігу окисно-відновного процесу іноді залежить від реакції середовища. Наприклад, у кислому середовищі сильний окисник перманганат-іон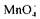 відновлюється доу
відновлюється доу лужному -— йони Мангану
лужному -— йони Мангану
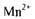 виступають як відновники, окиснюючись до
виступають як відновники, окиснюючись до У
У
нейтральному і опабколужному середовищах як у процесі окиснення, так і в процесі відновлення сполук Мангану утворюється тетрагідроксид Мангану — 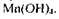 У сильнолужному середовищі сполуки Мангану окиснюються та відновлюються до манганат-іона
У сильнолужному середовищі сполуки Мангану окиснюються та відновлюються до манганат-іона
|
|
|
Вищесказане можна проілюструвати рівняннями реакцій:
у кислому середовищі йон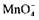 відновлюється сульфітом натрію до
відновлюється сульфітом натрію до
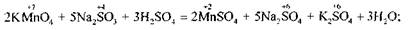
в нейтральному середовищі — до оксиду МпО2:

у сильнолужному середовищі —до аніона МпО^:

Вплив середовища на перебіг зазначених реакцій можна пояснити тим, що в кислому середовищі йони Гідрогену спричинюють сильну деформацію перманганат-іонів, послаблюють зв'язок між атомами Мангану й Оксигену, здатні відщеплювати атоми Оксигену й утворювати з ними молекули води. Внаслідок цього відновник реагує активніше.
У нейтральному середовищі аніони деформуються значно менше,
деформуються значно менше,
оскільки поляризаційна дія молекул води значно слабкіша, ніж йонів Н1.
Гідроксид-іони, навпаки, навіть сприяють зміцненню зв'язку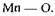
Якщо внаслідок реакції число атомів Оксигену, зв'язаних з атомом елемента-відновника зростає, то реакція середовища впливає на його відновні властивості. В цьому разі процес легше відбувається в лужному середовищі, оскільки джерелом атомів Оксигену є йони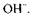 І, навпаки, в кислому
І, навпаки, в кислому
середовищі краще відбуваються характерні для атома елемента-окисника реакції, внаслідок яких число атомів Оксигену зменшується.
Кисле середовище сприяє процесам, в яких йонів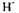 на відновлення віддається більше, ніж йонів
на відновлення віддається більше, ніж йонів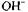 на окиснення. В протилежних випадках доцільно створювати лужне середовище. Якщо число йонів Н+ і ОН, що беруть участь у реакції, однакове, то реакцію можна проводити в нейтральному середовищі.
на окиснення. В протилежних випадках доцільно створювати лужне середовище. Якщо число йонів Н+ і ОН, що беруть участь у реакції, однакове, то реакцію можна проводити в нейтральному середовищі.
Для створення кислого середовища використовують розбавлений розчин сульфатної кислоти; розчини нітратної та хлоридної кислот не застосовують, оскільки перша з них є окисником, а друга — відновником.
Для створення лужного середовища використовують водні розчини гідроксиду калію або гідроксиду натрію.
Інколи вплив середовища настільки значний, що зумовлює зміну напрямку процесу. Так, реакція, що описується рівнянням
|
|
|

у лужному середовищі йде вправо, а в кислому — вліво.
У стехіометричних розрахунках для окисно-відновних процесів користуються молярними масами еквівалента окисника і відновника.
Молярна маса еквівалента речовини в реакціях окиснення — відновлення дорівнює молярній масі цієї речовини, поділеній на число електронів, які приєднує чи віддає окисник або відновник.
Наприклад, молярна маса еквівалента перманганату калію у реакції
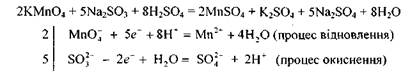
дорівнює
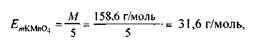
а молярна маса еквівалента сульфіту натрію —
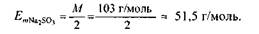
Розрізняють три типи окисно-відновних реакцій: міжмолекулярні, вну-трішньомолекулярні та реакції самоокиснення-самовідновлення (диспропор-ціонування).
Міжмолекулярні реакції відбуваються зі зміною ступеня окиснення атомів у різних молекулах, вони становлять найбільшу групу окисно-відновних реакцій, наприклад:

Під час перебігу міжмолекулярних реакцій обмін електронами відбувається між атомами, що входять до складу різних молекул.
Під час перебігу внутрішньомолекулярних окисно-відновних реакцій відбувається зміна ступеня окиснення атомів різних елементів, що входять до складу однієї й тієї самої молекули. До цих реакцій належать окисно-відновні реакції термічного розкладання, наприклад:

Реакції самоокиснення-самовідновлення відбуваються з одночасним збільшенням і зменшенням ступеня окиснення атомів одного й того самого елемента. Такі реакції можуть відбуватися лише між такими сполуками, в молекулах яких є атоми з проміжним ступенем окиснення, тобто такі сполуки можуть бути як окисниками, так і відновниками, наприклад:
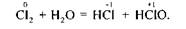
Існують деякі складні речовини, які за певних умов зазнають внутріш-ньомолекулярного окиснення — відновлення; у цьому разі одна складова частина речовини є окисником, а друга — відновником. Під час перебігу реакцій внутрішньомолекулярного окиснення — відновлення відбувається вирівнювання ступеня окиснення атомів одного й того самого елемента, тобто ці процеси можна назвати контрдиспропорціонуванням (контрдисмутацією), наприклад: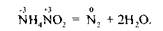
Такі процеси в неорганічній хімії трапляються значно рідше, ніж реакції диспропорціонування.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 4160; Нарушение авторских прав?; Мы поможем в написании вашей работы!