
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ііі. Види дисперсних систем
|
|
|
|
Запитання для самоперевірки
1. Які особливості розсіювання світла високодисперсними часточками?
2. Що таке коефіцієнт поглинання і екстинція?
3. Які властивості дисперсних систем називають молекулярно-кінетичними?
4. Чим обумовлена дифузія?
5. У чому полягає виникнення осмосу, осмотичного тиску?
6. Що таке стійкість дисперсних систем?
7. Охарактеризуйте седиментаційну стійкість, агрегативну стійкість.
8. Дайте характеристику ліофільним та ліофобним дисперсним системам.
9. Які особливості кінетики коагуляції електролітами?
10. Як визначають поріг коагуляції.
11. Які системи називають вільнодисперсними і пов’язанодисперсними?
Аерозолі – це дисперсні системи, в яких частинки дисперсної фази знаходяться у завислому стані («аеро» - характеризує газове дисперсійне середовище; «золь» - роздрібленість речовини, з якої утворена дисперсна фаза). Класифікують аерозолі залежно від агрегатного стану і розмірів частинок дисперсної фази. (табл. 3.1)
Таблиця 3.1 – Класифікація аерозолів
| Дисперсна фаза | Позначення | Назва |
| Рідка | 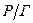
| Туман, краплі |
| Тверда | 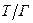
| Дим, пил |
| Рідка та тверда | 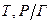
| Смог |
| Газові утворення | 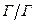
| Газові гідрати, клатрати. Утворення такої системи маловірогідне |
| Піна | 
| Рідка аерозольна піна |

| Тверда аерозольна піна |
Системи, дисперсна фази яких складається одночасно з рідких та твердих часток, називають смогом. До аерозолей відносять клатрати (у газовому середовищі можливі гетерогенні утворення за рахунок змінення густини у гомогенному газовому середовищі).
Особлива структура аерозолів – космічний пил та метеорити – виникає у космічному міжпланетному просторі. Аерозолі відіграють значну роль у життєдіяльності людини.
|
|
|
Концентрація і розміри частинок дисперсної фази аерозолів постійно змінюються. Утворення частинок дисперсної фази відбувається конденсійними методами чи диспергуванням.
Газове середовище обумовлює відмінність від систем з рідким середовищем, що обумовлене наявністю електричного заряду аерозольних частинок. Електричні заряди виникають внаслідок тертя твердих частинок при утворенні аерозолю, при подрібненні рідини, адсорбції йонів та ін. Заряд золю некомпенсований і є надлишковим, причому частинки можуть мати різний заряд. У звичайних умовах аерозольні частинки у повітрі слабкозаряджені (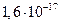 Кл), а внаслідок тертя електричні заряди частинок аерозолів можуть змінюватися на п’ять порядків (
Кл), а внаслідок тертя електричні заряди частинок аерозолів можуть змінюватися на п’ять порядків (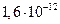 Кл).
Кл).
Для аерозолів характерні оптичні властивості дисперсних систем − інтенсивність релеївського розсіяння світла, коефіцієнт поглинання та екстинкція.
Для високодисперсних аерозолів характерні більш інтенсивні броунівський рух і дифузія, ніж для золів. Вони можуть перемішуватися як у вертикальному, так і в горизонтальному напрямках. Рух високодисперсних частинок аерозолів одного і того самого розміру в повітрі буде інтенсивніше, ніж у рідини. Седиментаційна стійкість аерозолів залежить від розміру частинок дисперсійного середовища і природи дисперсійного середовища. Для рідини швидкість осідання частинок набагато менша ніж у повітрі для одного і того самого розміру частинок.
В атмосфері Землі аерозолі утворюються під дією повітряного потоку і швидкість повітряного потоку, необхідну для переводу частинок у аерозольний стан, розраховують за формулою
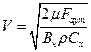 ,
,
де 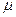 - коефіцієнт внутрішнього тертя;
- коефіцієнт внутрішнього тертя;  - густина повітря;
- густина повітря; 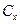 - коефіцієнт опору частинок;
- коефіцієнт опору частинок; 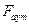 - сила аутогезії;
- сила аутогезії;  - площина перетину частинок.
- площина перетину частинок.
В атмосфері Землі аерозолі виникають внаслідок дії повітряного потоку, можуть утворитися внаслідок вибуху (Чорнобильська катастрофа), виверження вулканів, пожеж, роботи виробництв металургійної, хімічної і харчової промисловості та ін.
|
|
|
Більшість аерозолів є токсичними. Шкідлива дія аерозолів визначається гранично-допустимою концентрацією (ГДК). Значення встановлюється на основі дії найбільш небезпечного фактора.
За своїми властивостями до аерозолей близько відносяться порошки. Порошки – це сипучі матеріали, які належать до грубодисперсних систем 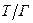 . Їх можна розглядати як осад аерозолів чи систем, одержаних диспергуванням. Сипучі матеріали можна перевести в аерозольний стан під дією повітряного потоку над поверхнею сипучого матеріалу.
. Їх можна розглядати як осад аерозолів чи систем, одержаних диспергуванням. Сипучі матеріали можна перевести в аерозольний стан під дією повітряного потоку над поверхнею сипучого матеріалу.
Порошки мають різні розміри частинок залежно від застосування. Так: газова капальна сажа має розмір 0,03-0,09 мкм; титанові білила – 0,2-0,7 мкм; осаджена крейда – 1-5 мкм; картопляний крохмаль – 100-150 мкм.
Порошки здатні до течії і розпилення, гранулювання.
До грубодисперсних систем відносять системи з рідким дисперсійним середовищем: суспензії, пасти, емульсії.
Раніше ми розглянули золі, які відносять до високодисперсних систем, вони здатні утворювати гелі. Перехід золю у стан гелю є гелеутворення, яке обумовлене виникненням просторової структури. На гелеутворення впливає ряд факторів:
- концентрація дисперсної фази;
- зменшення розмірів частинок;
- форма частинок;
- підвищення температури зменшує час гелеутворення, але внаслідок збільшення броунівського руху ліофобні гелі можуть переходити у структуровану рідину, а далі – у неструктуровану рідину;
- механічна дія (перемішування) перешкоджає утворенню геля. Здатність структур тіла їх руйнувати за допомогою механічної дії мимовільно відновлюватися має назву тіоксотропії. Тіоксотропні властивості виявляють деякі групи («пливуни»). Тіоксотропні властивості фарб дозволяють наносити їх на вертикальні поверхні після перемішування.
Гелі володіють незначною міцністю, еластичністю і деякою пластичністю. Їм властиво явище синерезиса – мимовільне зменшення розмірів гелю з одночасним виділенням з нього дисперсійного середовища, яке розміщено у петлях гелю. Синерезису сприяють всі фактори, які характерні для коагуляції.
|
|
|
Суспензії – це середньо-, грубодисперсні системи типу 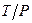 .
.
Суспензії не мають седиментаційної стійкості; молекулярно-кінетичні властивості слабко виявляються; дія світла на суспензії відбувається відповідно до законів геометричної оптики. Великий розмір частинок суспензій призводить до того, що електроосмос, потенціал седиментації є слабкими, а електрофорез взагалі відсутній. При збільшенні концентрації частинок дисперсної фази суспензій системи із вільнозв’язаних переходять у зв’язанодисперсні системи, які називають пастами. Пасти являють собою концентровані суспензії чи осад, які утворюються внаслідок втрати суспензіями седиментаційної стійкості. Вони можуть бути виготовлені штучно шляхом розтирання твердих тіл чи порошків у рідкому середовищі. Для виготовлення паст застосовують рідини, які мають підвищену в’язкість і температуру кипіння. Наприклад, деякі види зубних паст виготовляють шляхом змішування крейди із в’язкою рідиною, одержаною при варінні крохмалю у гліцериновому водному розчині з додаванням невеликої кількості ПАР.
Емульсіями називають дисперсні системи, в яких дисперсна фаза та дисперсійне середовище є взаємно нерозчинними або погано розчинними рідинами. Емульсії утворюють системи із сферичними частинками дисперсної фази розміром 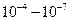 м у широкому діапазоні її концентрації (0,001 - 74 %). Вони мають здатність до обернення фаз.
м у широкому діапазоні її концентрації (0,001 - 74 %). Вони мають здатність до обернення фаз.
До синтетичних емульсій відносять маргарин, медичні препарати - синтоміцинову емульсію, емульсію тетрацикліну. До природних емульсій відносять масло, молоко, нафту.
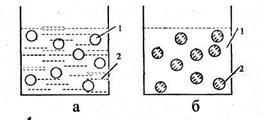
Рисунок 3.1 - Типи емульсій: а) пряма, масло у воді;
б) обернена, вода у маслі. 1-масло; 2 -вода
Практичний інтерес являють емульсії, у яких однією із рідин є вода (В), а іншою водонерозчинна рідина, яка має назву масло (М). За масло може бути використаний рідинний жир, мінеральні масла, бензен та ін. Залежно від складу дисперсної фази і дисперсійного середовища розрізняють прямі та обернені емульсії (рис. 3.1).
Прямі емульсії типу 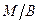 − це дисперсії масла у воді (молоко). Обернені емульсії типу
− це дисперсії масла у воді (молоко). Обернені емульсії типу 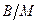 − це дисперсії води у маслі (маргарин). Визначити тип емульсії можна за допомогою барвника. Якщо барвник розчинний у дисперсійному середовищі, то емульсія забарвлюється у колір цього барвника. Порівнянням розчинності у двох рідинах барвника роблять висновок про тип емульсії.
− це дисперсії води у маслі (маргарин). Визначити тип емульсії можна за допомогою барвника. Якщо барвник розчинний у дисперсійному середовищі, то емульсія забарвлюється у колір цього барвника. Порівнянням розчинності у двох рідинах барвника роблять висновок про тип емульсії.
|
|
|
Залежно від концентрації дисперсної фази емульсії можуть бути розведеними (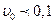 %), концентрованими (
%), концентрованими (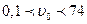 %), висококонцентрованими (
%), висококонцентрованими (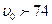 %), де
%), де 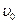 - об’ємна концентрація дисперсної фази у емульсії.
- об’ємна концентрація дисперсної фази у емульсії.
Об’ємну концентрацію розраховують за формулою
 ,
,
де 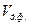 ,
, 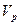 - об’ми дисперсної фази, дисперсійного середовища відповідно.
- об’ми дисперсної фази, дисперсійного середовища відповідно.
При 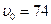 % відбувається перехід емульсії у висококонцентровану форму, при цьому часточки дисперсної фази здатні зберігати сферичну форму і щільну упаковку частинок одного і того самого розміру, тобто об’єм буде мінімальним. Якщо концентрація частинок дисперсної фази буде більше 74 %, то спостерігається деформація рідини і емульсії одержують нові властивості. Вони можуть зберігати свою форму і не розтікаються.
% відбувається перехід емульсії у висококонцентровану форму, при цьому часточки дисперсної фази здатні зберігати сферичну форму і щільну упаковку частинок одного і того самого розміру, тобто об’єм буде мінімальним. Якщо концентрація частинок дисперсної фази буде більше 74 %, то спостерігається деформація рідини і емульсії одержують нові властивості. Вони можуть зберігати свою форму і не розтікаються.
Мікроемульсії являють собою набухлі міцели колоїдних ПАР, тому їх ще називають міцелярними емульсіями. Концентрація 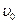 може досягати 50 %, а розмір міцел становить 10-100 нм, що відповідає високодисперсним системам.
може досягати 50 %, а розмір міцел становить 10-100 нм, що відповідає високодисперсним системам.
Емульсії можуть утворюватися мимовільно (характерно тільки для ліофільних систем) та штучно внаслідок механічного диспергування рідин, гомогенізацією.
Механічне диспергування рідини проводять перемішуванням, вібрацією чи струшуванням. Застосовують також гомогенізацію, яка відбувається за рахунок продавлювання рідини через отвіри, при цьому збільшується седиментаційна стійкість емульсії.
Стійкість емульсії визначається часом її існування і визначає їх застосування. Ліофільні емульсії (змащувально-охолоджувальні рідини) термодинамічно стійкі. Але їх мало, основні емульсії є ліофобними. Ліофобні емульсії термодинамічно нестійкі, мимовільно не утворюються, існують короткий час, тому потребують стабілізаторів (емульгаторів). Емульгатори − речовини, які підвищують агрегативну стійкість емульсій. До них належать ПАР, подрібнені порошки (тверді емульгатори).
ПАР є гідрофільними емульгаторами і вони краще розчиняються у воді, ніж у вуглеводнях. Для прямих емульсій полярні радикали, які утворюються на межі поділу фаз адсорбційного шару ПАР, розміщені на зовнішньому боці крапель масла і не дають можливості для їх зближення (рис. 3.2). Якщо маємо обернену емульсію, то поверхнево-активні речовини адсорбуються на внутрішньому боці молекул води і не перешкоджають злипанню частинок. Тому стабілізацію обернених емульсій проводять ПАР, які розчиняються у маслі.

Рисунок 3.2 – Адсорбція молекул ПАР: а) у прямих (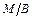 );
);
б) у обернених (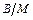 ) емульсіях
) емульсіях
Заміна емульгатора може призводити до обернення фаз, тобто пряма емульсія типу 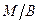 переходить у обернену емульсію типу
переходить у обернену емульсію типу 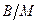 . При цьому дисперсійне середовище однієї фази переходить у дисперсну фазу іншої системи, а дисперсна фаза іншої рідини переходить в дисперсійне середовище знов утвореної емульсії. Обернення фаз може відбуватися і внаслідок механічної дії, і збільшення концентрації дисперсної фази.
. При цьому дисперсійне середовище однієї фази переходить у дисперсну фазу іншої системи, а дисперсна фаза іншої рідини переходить в дисперсійне середовище знов утвореної емульсії. Обернення фаз може відбуватися і внаслідок механічної дії, і збільшення концентрації дисперсної фази.
Ефективність емульгатора можна охарактеризувати відношенням між гідрофобною і гідрофільною частками молекул ПАР (гідрофільно-ліпофільний баланс – ГЛБ). ГЛБ є емпіричною безрозмірною величиною
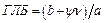 ,
,
де 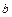 - параметр, який залежить від природи ПАР;
- параметр, який залежить від природи ПАР; 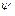 - вільна енергія взіємодії у розрахунку на одну
- вільна енергія взіємодії у розрахунку на одну 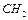 -групу;
-групу; 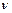 - число груп
- число груп 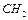 у вуглеводному радикалі;
у вуглеводному радикалі;  - cпорідненість полярної групи молекули ПАР до води.
- cпорідненість полярної групи молекули ПАР до води.
Величина 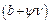 характеризує вільну енергію взаємодії неполярних груп молекул ПАР до вуглеводневої рідини.
характеризує вільну енергію взаємодії неполярних груп молекул ПАР до вуглеводневої рідини.
Для емульсій типу 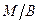 він становить 8-16, а для емульсій типу
він становить 8-16, а для емульсій типу 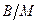 - 3-6. Стійкі адсорбційні шари утворюють білки, вуглеводи (
- 3-6. Стійкі адсорбційні шари утворюють білки, вуглеводи (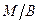 ). Наприклад, на поверхні еритроцитів, які є дисперсною фазою крові, адсорбуються молекули білка, амінокислот і йонів, які є емульгаторами і забезпечують стійкість всієї дисперсної системи.
). Наприклад, на поверхні еритроцитів, які є дисперсною фазою крові, адсорбуються молекули білка, амінокислот і йонів, які є емульгаторами і забезпечують стійкість всієї дисперсної системи.
Роль емульгаторів можуть виконувати порошки, розміри частинок яких повинні бути менше, ніж розміри частинок дисперсної фази. Дія їх заснована на вибірковому змочуванні частинок порошків маслом чи водою. Є гідрофільні порошки (глина, бентоніт, каолін, карбонати і сульфати), які змочуються водою і закріплюються з боку водної фази. До гідрофобних порошкоподібних емульгаторів відносять сажу, сульфіди важких металів, тверді частинки бітумів, нафти тощо. Їх застосовують у емульсіях типу 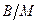 .
.
Особливості колоїдних ПАР простежуються на стадії миючої дії, яка полягає в утриманні забруднень у рідкому середовищі і не дає можливості осідання їх на поверхні. В основі миючої дії лежать такі колоїдно-хімічні процеси: змочування, адгезія, адсорбція, пептизація, солюбілізація, емульгування, суспендування, піноутворення.
Молекули мила (натрієві солі жирних кислот) мають здатність розчиняти як гідрофільні, так і ліпофільні речовини. Вони здатні до агрегації з утворенням сферичних структур − міцел. У міцели молекули мила зчеплені між собою вуглеводневими "хвостами", а полярні групи направлені до води. На межі поділу фаз (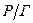 ), молекули мила виявляють поверхнево-активні властивості.
), молекули мила виявляють поверхнево-активні властивості.
За наявності на будь-якій поверхні забруднень молекули мила зчіплюються з гідрофобними частинками забруднень вуглеводневими «хвостами», утворюючи щільну ізолюючу плівку (рис. 3.3). Потім вклинюються між поверхнею і забруднюючою частинкою і, нарешті, відривають частинку, переводячи її в завислий стан у водному середоврщі. Особливістю колоїдних ПАР є утримання забруднень у рідкій фазі і запобігання їх осіданню. Застосування мил має недоліки: утворення нерозчинних солей з йонами кальцію та магнію; здатність до гідролізу, яка приводить до утворення лужного середовища. Тому застосовують детергенти.
Рисунок 3.3 – Схема миючої дії мила
Детергенти - це поверхнево-активні синтетичні мийні засоби. Детергенти поділяють на катіонні (четвертинні амонієві солі), аніонні (вуглеводні, до складу яких входить бензенсульфонатний залишок), нейтральні (похідні гліколей, вуглеводів). Синтетичні мийні засоби (СМЗ) не утворюють нерозчинних солей з катіонами кальцію, магнію (солями жорсткості); водні розчини мають нейтральну реакцію, бо оскільки нездатні гідролізуватися; виробництво їх не потребує використання цінних харчових продуктів (жирів). До складу СМЗ, крім колоїдної ПАР чи суміші ПАР, входять активні добавки, які поліпшують їх властивості.
Піни – це дисперсні системи типу 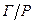 , в якої дисперсною фазою є газ чи пар, а також бульбашки повітря у воді. Піни відносять до концентрованих і висококонцентрованих дисперсних систем. Розведені дисперсні системи типу
, в якої дисперсною фазою є газ чи пар, а також бульбашки повітря у воді. Піни відносять до концентрованих і висококонцентрованих дисперсних систем. Розведені дисперсні системи типу 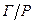 , які вміщуюють менше 0,1 % дисперсної фази називають газовими емульсіями. У них відбувається зворотня седиментація – вспливання газових бульбашок. У концентрованих і висококонцентрованих системах типу
, які вміщуюють менше 0,1 % дисперсної фази називають газовими емульсіями. У них відбувається зворотня седиментація – вспливання газових бульбашок. У концентрованих і висококонцентрованих системах типу 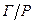 (пінах) бульбашки не мають можливості до вільного переміщування.
(пінах) бульбашки не мають можливості до вільного переміщування.
Піни характеризуються вмістом дисперсійного середовища. Для кількісної характеристики використовують кратність піни (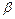 ), яка показує в скільки разів об’єм піни (
), яка показує в скільки разів об’єм піни (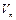 ) перевищує об’єм рідини (
) перевищує об’єм рідини ( ), необхідної для її формування
), необхідної для її формування
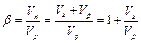 ,
,
де 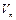 ,
,  ,
, - об’єми піни, газової дисперсної фази і рідкого дисперсійного середовища відповідно.
- об’єми піни, газової дисперсної фази і рідкого дисперсійного середовища відповідно.
Відносна доля повітря ( ) у піні
) у піні 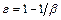 . Якщо
. Якщо  , то піни називають вологими; якщо
, то піни називають вологими; якщо  - сухими; а якщо
- сухими; а якщо 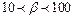 , то піни мають назву полусухих.
, то піни мають назву полусухих.
Піни відносять до грубодисперсних систем (полідисперсні системи, тому що бульбашки газу мають різні розміри), украй нестійких. Вони руйнуються за рахунок укрупнення бульбашок газу і даний процес називають коалесценцією.
Для пін характерні електроосмос, потенціал течії. Вони здатні поглинати і розсіювати світло. Володіють в’язкістю.
Піни відносять до термодинамічно нестійких ліофобних дисперсних систем. Для одержання пін і надання їм стійкості додають піноутворювачі, які є двох типів:
- дають малостійкі піни, час життя яких лише десятки секунд. До них відносять спирти, нижчі члени ряду жирних кислот та ПАВ, які не володіють миючою дією;
- час життя піни становить хвилину і даже годину. До них відносять мила і синтетичні колоїдні ПАР, білки, желатин та інші.
Іноді потрібно виключити піноутворення як небажаний процес. Для цього застосовують механічні (з допомогою мішалок, центрофуг), фізичні (нагрів, охолодження), хімічні (піногасники, до яких належать деякі ПАВ, жирні кислоти, естери, органічні сполуки) методи.
У дисперсних системах типу 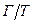 бульбашки газу оточені твердою оболонкою – тверді піни. Вони володіють міцністю і протидіють зовнішній дії сили. Тверді піни широко використовують у будівництві (пінопласти, пінобетон, піноскло). Тверді піни – типові представники харчової промисловості (пасти, зефір, суфле, хліб).
бульбашки газу оточені твердою оболонкою – тверді піни. Вони володіють міцністю і протидіють зовнішній дії сили. Тверді піни широко використовують у будівництві (пінопласти, пінобетон, піноскло). Тверді піни – типові представники харчової промисловості (пасти, зефір, суфле, хліб).
Особливими властивостями володіють капілярно-пористі тіла, тверде дисперсійне середовище якого пронизано порами капілярних розмірів (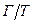 ,
,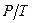 чи
чи  ). До них відносять деревину, тканини, папір, цеглину, грунт, деякі продукти харчування.
). До них відносять деревину, тканини, папір, цеглину, грунт, деякі продукти харчування.
Висоту підйому рідини (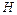 ) у капілярі визначають за формулою
) у капілярі визначають за формулою
 ,
,
якщо відбувається повне змочування, то  і
і  , формула набуває вигляду
, формула набуває вигляду

де 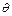 - краєвий кут змочування;
- краєвий кут змочування;  - густина рідини;
- густина рідини;  - радіус капіляра;
- радіус капіляра; 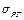 - поверхневий натяг;
- поверхневий натяг;  - прискорення вільного падіння.
- прискорення вільного падіння.
Капілярний підйом рідини має місце у грунті, рослинах, просоченні різних речовин.
Високомолекулярними сполуками (ВМС) називаються сполуки з відносною молекулярною масою від декількох тисяч до багатьох мільйонів, які утворені з великої кількості угрупувань, що повторюються і з’єднанні між собою хімічними зв'язками. За походженням ВМС поділяються на природні (білки, полісахариди, ДНК, РНК), штучні (одержані хімічною обробкою целюлози: штучний шовк, віскоза і т.д.) та синтетичні (утворюються внаслідок полімеризації чи поліконденсації).
За формою макромолекули ВМС поділяються на: лінійні (амілоза); розгалужені (амілопектин, глікоген) та сітчасті (гума).
За розмірами і молекулярною масою ВМС мають ознаки колоїдних розчинів. Проте розчинні ВМС не мають основної ознаки мікрогетерогенних систем поверхні і в суміші з розчинником дають термодинамічно стійкі розчини. Тому розчини біополімерів мають колоїдно-хімічні властивості (світлорозсіювання, осмос, дифузія та інші). Крім цього, їм притаманні специфічні властивості (денатурація, висолювання).
ВМС можуть перебувати тільки у конденсованих фазах − у вигляді твердих або рідких тіл, у тому числі розчинів. Розчинні ВМС містять частинки, розміри яких відповідають розмірам частинок  м (колоїдних розчинів). Так, наприклад, клубки ВМС можуть мати розміри до 100 нм, а молекули колоїдних поверхнево-активних речовин (ПАР) − групуватися в асоціати (міцели). Із двох ознак дисперсних систем (гетерогенність та дисперсність) розчини ВМС мають тільки одну − дисперсність. Властивості розчинів ВМС (оптичні, молекулярно-кінетичні, електрокінетичні, структурні) аналогічні колоїдним розчинам, тому розчинні ВМС та колоїдні ПАР розглядають як об’єкти колоїдної хімії.
м (колоїдних розчинів). Так, наприклад, клубки ВМС можуть мати розміри до 100 нм, а молекули колоїдних поверхнево-активних речовин (ПАР) − групуватися в асоціати (міцели). Із двох ознак дисперсних систем (гетерогенність та дисперсність) розчини ВМС мають тільки одну − дисперсність. Властивості розчинів ВМС (оптичні, молекулярно-кінетичні, електрокінетичні, структурні) аналогічні колоїдним розчинам, тому розчинні ВМС та колоїдні ПАР розглядають як об’єкти колоїдної хімії.
Термодинамічно стійкі істинні розчини ВМС утворюються мимовільно при контакті полімеру з розчинником, при цьому спостерігається збільшення об'єму і маси полімеру за часом і цей процес називають набуханням. Процес набухання характеризується ступенем набухання  :
:
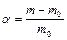 або
або 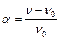 ,
,
де 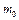 ,
, 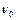 − відповідно маса та об'єм полімеру до набухання;
− відповідно маса та об'єм полімеру до набухання;  ,
, 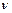 − маса і об'єм полімеру після набухання.
− маса і об'єм полімеру після набухання.
Процес набухання описується кінетичним рівнянням першого порядку і визначається експериментально. Стала швидкості набухання розраховується за формулою
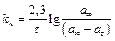 ,
,
а швидкість набухання (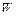 ) за формулою
) за формулою
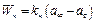 ,
,
де 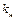 - стала швидкості набухання;
- стала швидкості набухання; 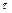 - час набухання;
- час набухання; 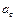 - ступінь набухання за час
- ступінь набухання за час 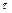 ;
;  - гранична ступінь набухання.
- гранична ступінь набухання.
У випадку, коли процес проходить за умов, що виключають збільшення об'єму полімерного зразка, визначається тиск набухання. Тиск набухання визначають за формулою
 ,
,
де 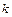 - коефіцієнт, який залежить від природи ВМС, розчинника та температури;
- коефіцієнт, який залежить від природи ВМС, розчинника та температури; 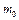 - вміст сухої речовини у набухненому студні;
- вміст сухої речовини у набухненому студні;  - коефіцієнт, який приблизно дорівнює 3.
- коефіцієнт, який приблизно дорівнює 3.
Набухання і розчинення ВМС залежать від хімічної природи полімеру та розчинника, в'язкості розчинника, молекулярної маси полімеру. Набухання полімеру відбувається внаслідок однобічної дифузії молекул розчинника у полімерне тіло і проходить в декілька стадій:
- спочатку поглинається невелика кількість розчинника, при цьому виділяється теплота набухання і утворюється мономолекулярна сольватна оболонка біля полімеру. Відбувається зміна властивостей розчинника − тиск насиченої пари і діелектрична проникність зменшується, а густина − збільшується;
- обмежене поглинання великої кількості рідини призводить до утворення еластичних драглів, які є структурованими системами із вмістом вільної та зв'язаної води і мають властивості синерезису;
- необмежене набухання закінчується утворенням істинного розчину молекулярного ступеня дисперсності (набухання желатину у гарячій воді).
Підвищення температури прискорює процес набухання. Надмолекулярна структура відіграє значну роль.
Набухання поліелектролітів у воді залежить від pH середовища. Для поліамфолітів, до яких належать білки, характерна наявність двох типів груп 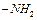 і
і 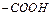 . В ізоелектричній точці (ІЕТ) кількість іонізованих основних груп дорівнює кількості іонізованих кислотних груп. Набухання у цьому стані є мінімальним, тому що макромолекула білка згортається у щільний клубок. Поява надлишкового заряду при збільшенні або зменшенні рН середовища сприяє розгортуванню молекул, і набухання збільшується.
. В ізоелектричній точці (ІЕТ) кількість іонізованих основних груп дорівнює кількості іонізованих кислотних груп. Набухання у цьому стані є мінімальним, тому що макромолекула білка згортається у щільний клубок. Поява надлишкового заряду при збільшенні або зменшенні рН середовища сприяє розгортуванню молекул, і набухання збільшується.
Як ми вже казали, обмежене набухання призводить до утворення драглів. Драглі отримують із розчинів ВМС. Драглі, які вміщують невелику кількість (менше 1 % сухої речовини), називають ліогелями (медузи).
Процес утворення драглів не супроводжується встановленням нових зв'язків, а спостерігається розтягнення структурної решітки за рахунок проникнення розчинника у пустоти, і ковалентні зв'язки залишаються.
Гелеутворення відбувається у випадку переходу золю в гель і обумовлене появою просторової структури. Взагалі драглі і гелі розрізняються тільки методом одержання: драглі − із розчинів ВМС, а гелі − із золів. Природними гелямі є кришталик ока, цитоплазма клітин. Гелі можуть під впливом механічної дії переходити в золі і після зняття нагрузки знову в гелі. Це явище набуло назви тиксотропії.
З часом відбувається процес старіння драглів і гелів, який приводить до утворення двох фаз (синерезис). При цьому структурна решітка стягується і витісняє рідину з утворенням збідненого розчинником золю і збагаченого розчинником гелю (спостерігається зменшення об'єму, прозорості). В організмі людини це явище спостерігається при старінні.
Під дією електролітів стійкість порушується і може відбуватися випадання ВМС в осад. Процес осаджування розчиненого білка під дією електролітів називають висолюванням. Для висолювання білків необхідні більш високі концентрації електролітів порівняно з коагуляцією золів. Електроліти десольватують макромолекули і зменшують їх розчинність. Висолювання пов'язане з порушенням сольватної (гідратної) оболонки, яку оточують макромолекули ВМС, при цьому полярні молекули розчинника взаємодіють з електролітами. За кінцевим результатом висолювання схоже на денатурацію, оскільки утворюється осад. Висолювання і випадіння осаду білка зумовлене зниженням його розчинності у концентрованому розчині електроліту. За впливом на процес висолювання аніони і катіони розміщуються в ліотропні ряди, які мають назву рядів Гофмейстера
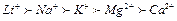 ,
,

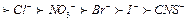 .
.
Висолювання може проходити під дією огранічних сполук (спиртів, ацетону), які при взаємодії з водою гідролізують і руйнують гідратну оболонку, тобто сприяють процесу висолювання.
При висолюванні білків та інших ВМС спостерігається утворення крапель нової рідкої фази, яку називають коацерватом, а сам процес – коацервацією. Коацервція - це процес утворення асоціатів, які складаються з декількох макромолекул. Асоціати можуть формувати нову фазу. Коацервація може проходити при зниженні температури і не супроводжуватися висолюванням.
Для білків характерна денатурація. Денатурація макромолекул білків, які знаходяться у нативному стані, пов'язана з порушенням конформації поліпептидного ланцюга та їх внутрішньомолекулярної взаємодії без розриву поліпептидних зв'язків. Незначне порушення в структурі білка зумовлює оборотну денатурацію (відновлення нативних властивостей після зняття зовнішньої дії). Поширена денатурація білка при термічній обробці. Спостерігається також і кислотна денатурація (скисання молока). Це є так звана необоротна денатурація.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1871; Нарушение авторских прав?; Мы поможем в написании вашей работы!