
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Предмет электрохимии. Основные понятия. Основные положения теории Аррениуса и ее недостатки
Электрохимия – раздел физической химии, в котором изучаются законы взаимодействия и взаимосвязи химических и электрохимических явлений.
Курс теоретической электрохимии можно разделить на две части:
I часть – теория электролитов (в некоторых литературных источниках называется ионика). Учение о свойствах электролитов (главным образом о водных растворах как наиболее часто встречающихся на практике и наиболее полно изученных);
II – термодинамика и кинетика электродных процессов (в некоторых литературных источниках называется электродика). В этом разделе изучаются равновесные состояния электрохимических процессов и законы их протекания во времени.
Прикладные направления электрохимии:
1. процессы электролиза и электросинтеза применяются при получении химических продуктов на электродах при прохождении электрического тока через раствор. Например, получение Cl2, щелочей, очистка цветных металлов;
2. процессы электролиза в гальванотехнике для электропокрытия металлами (антикоррозийные покрытия);
3. создание химических источников тока с помощью электрохимических реакций (гальванические элементы (батарейки), аккумуляторы, топливные элементы);
4. электрохимические методы химического анализа (кондуктометрия, вольтамперометрия, потенциометрия, полярография).
Основной предмет изучения электрохимии – это процессы, протекающие на электродах при прохождении электрического тока через раствор (так называемые электродные или электрохимические процессы).
Одним из объектов изучения электрохимии являются вещества (или их растворы) способные проводить электрический ток.
Проводники І рода – вещества, в которых прохождение электрического тока осуществляется посредством движения электронов. Для проводников І рода характерна электронная проводимость. К ним можно отнести твердые и жидкие металлы, некоторые неметаллы (графит, сульфиды Zn, Pb).
Проводники ІІ рода – это вещества, в которых прохождение электрического тока, осуществляется посредством движения ионов. Проводники ІІ рода обладают ионной проводимостью. К ним можно отнести водные растворы кислот, оснований, солей, расплавленные соли, некоторые твердые соли и т. д. Проводники ІІ рода иначе называются электролитами.
Электролиты – это вещества, которые способны распадаться на ионы в растворе и проводить электрический ток.
Сильные электролиты – это вещества, которые в растворе частично распадаются на ионы и хорошо проводят электрический ток. Например, водные растворы H2SO4 , HCI, NaOH, NaCI и т. д.
Слабые электролиты – это вещества, которые в растворе частично распадаются на ионы и слабо проводят электрический ток. Например, водные растворы CH3COOH, NH4OH и т. д.
Растворы слабых и сильных электролитов имеют свои особенности и закономерности, их поведение подчиняется разным законам и описывается разными теориями.
В 1883 г. Аррениус предложил теорию электролитической диссоциации, которая в последствие получила название теории слабых электролитов.
Согласно этой теории, процесс распада веществ в растворе на ионы называют электролитической диссоциацией.
Основные положения теории Аррениуса:
1. Кислота – это вещества, диссоциирующие на ион H+ и анион.
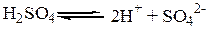
Основания распадаются при диссоциации на гидроксил-ион 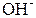 и катион.
и катион.

Соли диссоциируют на катион и анион.
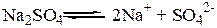
2. Соли являются сильными электролитами и полностью диссоциируют на ионы. Кислоты и основания могут быть сильными и слабыми электролитами (следовательно, диссоциируют как полностью, так и частично).
3. Процесс диссоциации электролитов на ионы является равновесным. Равновесие устанавливается между ионами и непродиссоциированными молекулами.
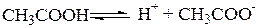
Равновесный процесс диссоциации характеризуется константой равновесия, которая называется константой диссоциации, обозначается Кс и определяется по закону действующих масс.
Закон действующих масс: отношение произведения концентраций продуктов реакции, взятых в степенях соответствующих их стехиометрическим коэффициентам, к такому же произведению для исходных веществ, есть величина постоянная, и называется константой диссоциации.

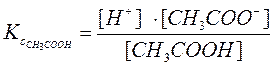
[H+], [CH3COO-], [CH3COOH] – равновесные концентрации;
Кс – концентрационная константа диссоциации. Зависит от температуры, природы растворителя, электролита, но не зависит от концентрации электролита.
Степень диссоциации (α) – доля молекул продиссоциировавших на ионы. Зависит от температуры, концентрации электролита, природы растворителя и электролита.
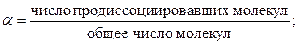

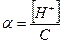
Для сильных электролитов 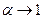 .
.
Для слабых электролитов 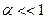
Величина α связана с Кс законом разведения Оствальда, который для бинарного (одно-одновалентного) электролита записывается следующим образом:
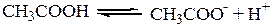
(1-α)·С С · α С · α

где С – исходная молярная концентрация электролита; 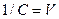 - разведение раствора – это объем, в котором содержится 1 моль электролита (л/моль).
- разведение раствора – это объем, в котором содержится 1 моль электролита (л/моль).
Для слабых электролитов 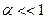 , тогда
, тогда

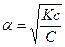
Теория Аррениуса имеет ряд недостатков:
1. не учитывает взаимодействие между ионами в растворе. Согласно теории Аррениуса, ионы в растворе распределены хаотично. Если это так, то раствор электролита идеальный. В реальности, это применимо только к слабым электролитам, поэтому данную теорию называют теорией слабых электролитов;
2. не учитывает взаимодействие ионов с растворителем;
3. не учитывает природу растворителя;
4. не объясняет причину диссоциации электролитов в растворе на ионы.
В действительности распад вещества на ионы в растворе осуществляется за счет того, что при диссоциации энергия (Е) взаимодействия между ионами в кристалле (Еион-ион – энергия ион-ионного взаимодействия) становится меньше Е взаимодействия иона с диполем растворителя (Е ион-дип – энергия ион-дипольного взаимодействия). Ионы «вырываются» молекулами растворителями из кристаллической решетки вещества, и происходит процесс диссоциации (распада) вещества на ионы. Условие диссоциации вещества на ионы в растворе: Е ион-ион. < Е ион-дип.
Таким образом, теория электролитической диссоциации показала, что между сильными и слабыми электролитами существуют явные различия. Рассмотрим их:
| Слабые электролиты | Сильные электролиты |
1. Степень диссоциации 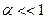 .
2. Концентрация ионов в растворе мала.
3. Расстояние между ионами в растворе велико.
4. Взаимодействием между ионами в растворе можно пренебречь (раствор идеальный)
5. Для характеристики идеальных растворов (слабых электролитов) используют понятие концентрации: C, m, Cн. .
2. Концентрация ионов в растворе мала.
3. Расстояние между ионами в растворе велико.
4. Взаимодействием между ионами в растворе можно пренебречь (раствор идеальный)
5. Для характеристики идеальных растворов (слабых электролитов) используют понятие концентрации: C, m, Cн.
| 1. Степень диссоциации α → 1. 2. Концентрация ионов в растворе велика. 3. Расстояние между ионами в растворе мало. 4. Учитывается взаимодействие между ионами в растворе (раствор реальный). 5. Для характеристики реальных растворов (сильных электролитов) используют понятие активности а. |
|
|
Дата добавления: 2014-01-06; Просмотров: 7017; Нарушение авторских прав?; Мы поможем в написании вашей работы!