
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
А параллельне реакции
|
|
|
|
 С
С
Уравнение сложной реакции не отражает ее механизм, а является лишь алгебраической суммой отдельных стадий, например:
А + В ® C + D
1) A ® X + C
2) X + B ® D
По признаку молекулярности реакции делятся на моно -, би - и тримолекулярные.
Молекулярность - это число частиц, участвующих в элементарном акте химического взаимодействия.
Мономолекулярные реакции:
I2 ® 2I
NH4SCN ® (NH2)2CS
Бимолекулярные реакции:
CO + Cl2 ® COCl2
2HI ® H2 + I2
Тримолекулярные реакции:
2NO + Cl2 ® 2 NOCl
Понятие молекулярность применимо только к простым реакциям или к элементарным стадиям сложных реакций. Реакции с молекулярностью выше трех маловероятны и не известны.
По фазовому состоянию реагирующих веществ различают гомогенные и гетерогенные реакции.
Гомогенные реакции протекают в пределах одной фазы, например, в смеси газов или в растворе.
Гетерогенные реакции протекают на границе раздела фаз, например, твердой и жидкой, твердой и газообразной.
В ходе гомогенной реакции химические взаимодействия происходят по всему объему системы. Скорость гомогенной реакции определяется числом взаимодействий в единицу времени в единице объема и измеряется изменением концентрации одного из реагирующих веществ в единицу времени. Так как концентрация исходных веществ уменьшается (dC<0), а продуктов реакции - растет (dC>0), перед дробью ставят знак + или - так, чтобы скорость всегда была положительной (рис.1):
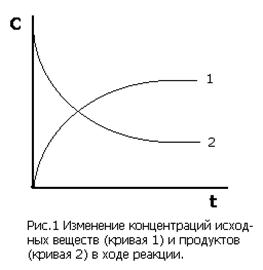
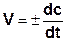 (1)
(1)
Единица измерения скорости реакции -моль/л с.
Скорость реакции зависит от многих факторов. Основные факторы, влиящие на скорость реакции:
- природа реагирующих веществ
- концентрация
- температура
- катализатор.
Зависимость скорости от концентрации исходных веществ выражается законом действующих масс. Закон открыт опытным путём К. Гульдбергом и П. Вааге в 1867г.
|
|
|
аА + bВ = сС + dD
υ = k[A]p[B]q, где k – константа скорости химической реакции;
[A], [B] – концентрации исходных веществ;
а, b, - стехиометрические коэффициенты.
Скорость химической реакции прямо пропорциональна произведению концентраций исходных веществ, взятых в некоторых степенях.
Зависимость скорости от концентрации реагирующих веществ, называется кинетическим уравнением химической реакции.
Константа скорости химической реакции – одна из основных кинетических характеристик данной реакции.
Константа скорости равна скорости реакции при концентрациях реагентов, равных 1 моль/л, т.е. удельной скороcти реакции. Константа скорости реакции зависит от природы реагентов, температуры, катализатора и не зависит от концентрации реагентов.
Порядок реакции показывает характер зависимости скорости реакции от концентрации. Известны реакции нулевого, первого, второго, третьего и дробных порядков
Для простых реакций частные порядки по отдельным реагентам совпадают с их стехиометрическими коэффициентами: p=a и q=b, а общий порядок с молекулярностью реакции, например:
I2 ® 2 I 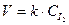
H2 + I2 ® 2 HI 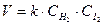
2 NO + Cl2 ® 2 NOCl 
Для сложных реакций - p¹a и q¹b, например:
2 N2O5 ® 4 NO2 + O2 
2HI + H2O2 ® 2 H2O + I2 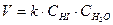
2 NO2 + 4 H2 ® 4 H2O + N2 
N2 + O2 ® 2 NO 
Порядок реакции устанавливается экспериментально и зависит от механизма реакции. Если процесс включает несколько последовательных стадий, то порядок реакции будет определяться молекулярностью медленной стадии, которая лимитирует скорость всего процесса, например:
2 N2O5 ® 4 NO2 + O2 

стадия 1: N2O5 ® N2O3 + O2 медленно
стадия 2: N2O5 + N2O3 ® 4 NO2 быстро
Зависимость скорости от концентрации реагирующих веществ, называется кинетическим уравнением химической реакции.
Гетерогенные реакции – это химические реакции с участием веществ, находящихся в разных фазах и образующих гетерогенную систему. Гетерогенные реакции протекают на поверхности раздела фаз.
|
|
|
Примерами гетерогенных реакций могут служить процессы
горения твердых веществ:
C(к) + O2(г)® CO2(г);
восстановления оксидов металлов углеродом:
Fe3O4(к) + 2C(к) ® 3Fe(к) + 2CO2(г);
растворения металлов в кислотах:
Zn(к) + 2HCl(р) ® ZnCl2(к) + H2(г).
Гетерогенные реакции – это сложные процессы, которые включают несколько последовательных стадий:
1) подвод реагентов к поверхности раздела фаз путем диффузии;
2) адсорбция реагентов на поверхности раздела фаз;
3) химическое взаимодействие;
4) десорбция продуктов реакции с поверхности раздела;
5) отвод продуктов от поверхности раздела путем диффузии.
Каждая из перечисленных стадий имеет свою скорость. Скорость процесса в целом определяется скоростью самой медленной (лимитирующей) стадии и описывается ее законами. Поэтому не существует единой формы кинетического уравнения для гетерогенных процессов. Если лимитирующей стадией процесса является химическое взаимодействие, то скорость химической реакции определяется законом действия масс. Если же сама химическая реакция протекает быстро, то скорость гетерогенного процесса будет определяться скоростью подвода реагирующих веществ к поверхности раздела и описываться уравнениями диффузионной кинетики.
Зависимость скорости от концентрации реагирующих веществ, называется кинетическим уравнением химической реакции.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 525; Нарушение авторских прав?; Мы поможем в написании вашей работы!