
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия и определения химической термодинамики
|
|
|
|
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Введение
II. Объяснение нового материала.
I. Организационный момент. Знакомство с новой дисциплиной.
Ход лекции
Внутренняя энергия, энтальпия, первый закон термодинамики, тепловой эффект, закон Гесса.
Цели:
Обучающие:
− Сформировать представление о понятиях «внутренняя энергия», «энтальпия», «тепловой эффект».
− Рассмотреть сущность первого закона термодинамики, закона Гесса и следствия, вытекающие из него.
− Объяснить роль первого закона термодинамики в химии.
Развивающие:
− Развитие у студентов навыков наблюдения, логического мышления, умений делать выводы и заключения.
Воспитывающие: воспитать любовь к предмету. Чувство уважения к своим товарищам, гуманного отношения к природе, уметь слушать собеседника.
Методы: объяснение, рассказ, леция.
Химия нефти и газа - обособленная часть химической науки, в рамках которой изучение нефтегазовых систем осуществляют на основе аналитического и коллоидно-химического подходов. Методология аналитического подхода предполагает знание совокупности физико-химических методов разделения сложных многокомпонентных нефтегазовых систем и идентификации их компонентов.
Одной из важнейших задач курса химии нефти и газа является изучение состава нефтей и природных газов с помощью физических и физико-химических методов исследования. Химия нефти занимается также изучением физико-химических свойств углеводородов и неуглеводородных компонентов нефти в связи с их строением.
Химическая термодинамика – это раздел химии, который изучает:
- переход энергии из одной формы в другую, от одной части системы к другой;
|
|
|
- тепловые эффекты, сопровождающие химические и физические процессы;
- возможность и направление самопроизвольного протекания процессов.
Термодинамической системой называется тело или группа тел, находящихся во взаимодействии друг с другом и которые мысленно обособлены от окружающей среды.
Системы бывают:
- открытыми – могут обмениваться с окружающей средой и веществом и энергией;
- закрытыми – могут обмениваться с окружающей средой только энергией;
- изолированными – не могут обмениваться с окружающей средой ни веществом, ни энергией.
| Тип системы | Обмен энергией | Обмен веществом |
| изолированная | нет | нет |
| закрытая | есть | нет |
| открытая | есть | есть |
С другой стороны, системы бывают гомогенными и гетерогенными. В гомогенных системах вещества находятся в одной фазе, в гетерогенных – в разных фазах, т.е. в гетерогенных системах существуют поверхности раздела. Фазой называется гомогенная часть системы, характеризующаяся одинаковыми физико-химическими свойствами и отделенная от других частей системы поверхностью раздела.
Термодинамическая система характеризуется различными физико – химическими свойствами, которые называются термодинамическими параметрами или просто параметрами. Так идеальный газ характеризуется такими параметрами как температура Т, объём V и давление Р. Все параметры системы связаны между собой. Эту связь выражает уравнение состояния системы. Если система характеризуется такими параметрами как Т, V и P, то в общем виде уравнение состояния системы выражается уравнением
(Т,V,P) = 0 (1.1)
В качестве примера конкретного уравнения состояния может служить уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
РV = nRT, (1.2)
где n - число молей идеального газа,
R = 8,314 - универсальная газовая постоянная, 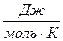 .
.
Свойства системы называются параметрами состояния системы.
|
|
|
Свойства системы можно разбить на две группы: экстенсивные и интенсивные. Экстенсивными называются свойства, которые зависят от массы системы. Примером экстенсивного свойства может служить объём системы. Интенсивными называются свойства, которые не зависят от массы системы. Примером таких свойств идеального газа могут служить температура и давление.
Параметры интенсивности не зависят от количества вещества (температура, давление, плотность), параметры экстенсивности зависят от количества вещества (масса, объём, площадь поверхности раздела).
В термодинамической системе протекают термодинамические процессы. Термодинамическим процессом называется всякое изменение в системе, связанное с изменением хотя бы одного параметра. Различают следующие основные термодинамические процессы, протекающие в системе:
- процесс, протекающий при постоянной температуре (Т = const), который называется изотермическим;
- процесс, протекающий при постоянном объёме (V=const)- изохорный;
- процесс, протекающий при постоянном давлении (P=const) – изобарный;
- процесс, протекающий при постоянных температуре и объёме (T = const и V = cоnst), – изохорно- изотермический;
- процесс, протекающий при постоянных температуре и давлении (Т =const и P = const), - изобарно – изотермический.
Цикл – это цепь последовательных превращений, при которых все параметры системы возвращаются к исходным значениям. При протекании кругового процесса изменение любого параметра системы равно нулю.
Изменение некоторых свойств системы не зависит от пути протекания процесса, а зависит только от начального и конечного состояния системы. Такое свойство системы называются функцией состояния. К таким функциям можно отнести термодинамические параметры системы Т, Р и V. Любая функция состояния характеризуется полным дифференциалом.
Конечным состоянием протекания любого процесса в термодинамической системе является состояние равновесия. Состоянием равновесия называется такое состояние, при котором параметры системы остаются неизменными во времени без каких-либо изменений в окружающей среде. Если параметры системы остаются постоянными во времени за счёт каких – либо изменений в окружающей среде, то такое состояние называется стационарным.
|
|
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 244; Нарушение авторских прав?; Мы поможем в написании вашей работы!