
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основной закон термохимии - закон Гесса
|
|
|
|
Закон Гесса: тепловой эффект химической реакции не зависит от пути её протекания, а определяется только начальным и конечным состоянием участников реакции и их природой.
Закон Гесса можно продемонстрировать схемой превращения углерода в его оксид

+ О2



 С(тв) СО2(газ)
С(тв) СО2(газ)

 ΔН1
ΔН1
+ 0,5O2 ΔH2 ΔН3 +0,5О2
CO
Тепловой эффект по пути 1 равен сумме тепловых эффектов по пути 2 и 3:
ΔН1 = ΔН2 + ΔН3 (1.32)
Из закона Гесса вытекает несколько следствий, которые широко используются для термохимических расчётов.
Первое следствие гласит: тепловой эффект химической реакции равен по величине и противоположен по знаку тепловому эффекту обратной химической реакции. Например, для реакции
СаСО3(тв) = СаО(тв) + СО2(газ) + 21,77 кДж (1.33)
СаО(тв) + СО2(газ) = СаСО3(тв) – 21,77 кДж. (1.34)
Согласно второму следствию, тепловой эффект любой химической реакции равен сумме теплот образования продуктов реакции минус сумму теплот образования исходных веществ с учётом стехиометрических коэффициентов.
Под теплотой образования понимают тепловой эффект химической реакции образования одного моля вещества из простых веществ. Теплота образования простого вещества принята равной нулю. Например, стандартный тепловой эффект химической реакции
2Fe2O3(тв) + С(тв) = 4FeO(тв) + СО2(газ) (1.35)
при температуре 298 К равен
ΔН = 4ΔН
= 4ΔН (FeO) + ΔН
(FeO) + ΔН (CO2) - 2ΔН
(CO2) - 2ΔН (Fe2O3) (1.36)
(Fe2O3) (1.36)
где ΔН (i)- теплота образования i – го участника реакции.
(i)- теплота образования i – го участника реакции.
Величины теплот образования различных соединений при температуре 298 К приведены в термодинамических таблицах.
Пример расчёта теплового эффекта химической реакции:
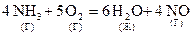 ; DН =?
; DН =?
| Вещество | ΔН0298, кДж/моль |
| NH3(г) | -46,2 |
| О2(г) | |
| Н2О(ж) | -285,8 |
| NO(г) | 90,3 |
|
|
|
 =
=
=  кДж.
кДж.
Третье следствие гласит: тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ минус сумму теплот сгорания продуктов реакции с учётом стехиометрических коэффициентов.
Под теплотой сгорания понимают тепловой эффект химической реакции сгорания одного моля вещества до высших оксидов. Например, тепловой эффект химической реакции
С(тв) + 2Н2(газ) = СН4(газ) (1.37)
при температуре 298 К равен
ΔН = ΔН
= ΔН (С) + 2ΔН
(С) + 2ΔН (Н2) - ΔН
(Н2) - ΔН (СН4) (1.38)
(СН4) (1.38)
где ΔН (i)- теплота сгорания i – го участника реакции.
(i)- теплота сгорания i – го участника реакции.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 489; Нарушение авторских прав?; Мы поможем в написании вашей работы!