
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Углеводородных газов
|
|
|
|
Аддитивный подход расчета физико-химических свойств
Нефтяной газ при нормальных условиях содержит неполярные углеводороды – смесь углеводородов от С1 до С4: метан, этан, пропан, изо-бутан и н-бутан. С точки зрения физики к газам можно применять законы для идеальных систем.
То есть нефтяной газ – это идеальная система.
С точки зрения химии – идеальным называется газ силами взаимодействия между молекулами которого можно пренебречь.
С точки зрения термодинамики идеальным называется газ, для которого справедливы равенства:
(∂Е / ∂V)T = 0, z = P·V/Q·R·T = 1, (2.8)
где Е – внутренняя энергия парообразования, Дж/моль;
z – коэффициент, характеризующий степень отклонения реального газа от закона идеального газа.
С точки зрения математики – это аддитивная система. Следовательно, для оценки свойств нефтяного газа (при нормальных или стандартных условиях) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
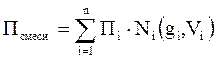 , (2.9)
, (2.9)
где Ni – мольная доля;
gi – весовая доля;
Vi – объёмная доля;
Пi – параметр i-го углеводорода или неуглеводородного компонента.
Аддитивный подход к расчёту физико-химических и технологических параметров означает, что каждый компонент газа в смеси ведет себя так, как если бы он в данной смеси был один.
Для идеальных газов давление смеси газа равно сумме парциальных давлений компонентов (закон Дальтона):
 , (2.10)
, (2.10)
где Р – давление смеси газов;
рi – парциальное давление i-го компонента в смеси,
или
 , (2.11)
, (2.11)
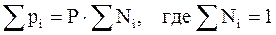 . (2.12)
. (2.12)
То есть парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов.
Аддитивность парциальных объёмов (Vi) компонентов газовой смеси выражается законом Амага:
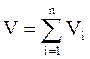 , (2.13)
, (2.13)
где V – объём смеси газов;
Vi – объём i-го компонента в смеси.
или аналогично уравнениям 2.11–2.12 объём компонента газа можно оценить:
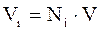 . (2.14)
. (2.14)
Как аддитивную величину рассчитывают и плотность смеси газов:
 , (2.15)
, (2.15)
где ρi – плотность i–го компонента;
Ni – мольная доля i–го компонента.
Молекулярная масса смеси рассчитывается по принципу аддитивности для смесей, состав которых выражен в мольных или объёмных долях по формуле 2.14 (левое выражение). Для смесей, состав которых выражен в массовых процентах по формуле 2.14 (правое выражение):
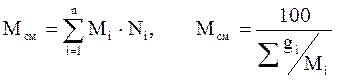 . (2.16)
. (2.16)
Рассмотрим пример. При приготовлении рекомбинированной пробы смешивают следующие объёмы (V) газов: 100 м3 пропана (C3H8), 75 м3 изобутана (i-С4Н10) и 75 м3 нормального бутана (n-С4Н10).
Найти молекулярную массу смеси (Мсм).
Дано: Vi, м3 Mi, кг/моль
C3H8 100 44
i-C4H10 75 58
n-C4H10 75 58
Решение. Находим общий объём газовой смеси: 100+75+75=250 (м3), и рассчитываем ее состав в объёмный процентах:
250 м3 – 100 %,
100 м3 – Х %;
Х = 100•100 / 250 = 40 (%) или VC3H8 = 0,4 (в долях);
i-C4H10 – X % Þ X = 75•100 / 250 = Vi-C4H10 = 30 % = 0,3 (в долях);
n-C4H10 – 30 % Þ Vn-C4H10 = 30 % = 0,3 (в долях).
Зная, что Vi = Ni, и зная молекулярные массы компонентов смеси: C3H8 – 44; C4H10 – 56, рассчитаем величину Mсм:
Mсм = S Mi•Ni = 44•0,4 + 58•0,3 + 58•0,3 = 17,6 + 17,4•2 = 52,4 (кг/моль).
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 289; Нарушение авторских прав?; Мы поможем в написании вашей работы!