
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика органических реакций
|
|
|
|
В основу классификации органических реакций могут быть положены различные принципы.
I. Классификация химических реакций по результату химического превращения:
1. Реакции замещения (символ S):
СН3–СН3 + Сl2 → СН3СН2Сl + НСl
Замещаться в органической молекуле могут атомы водорода или другого элемента, кроме углерода.
2. Реакции присоединения (символ А):
СН2=СН2 + Сl2→ СН2Сl –СН2Сl
К реакциям присоединения способны органические соединения, имеющие кратные связи >С=C<, >C=O, –C≡N, –N=N–, а также атомы со свободными электронными парами или вакантными орбиталями.
3. Реакции элиминирования или отщепления (символ Е):
СН3–СН2–OН → СН2=CH2 + H2O
Легко элиминируются (отщепляются) такие вещества, как вода, галогеноводороды, аммиак.
II. Классификация реакций по механизму процесса.
Механизм реакции – это последовательность элементарных стадий, через которые она протекает. По механизму реакции могут быть радикальными или ионными.
1. Радикальные реакции осуществляются путем гомолитического разрыва ковалентной связи в исходной молекуле
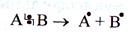
Связующая электронная пара делится пополам между партнерами разорвавшейся связи, при этом образуются свободные радикалы - частицы с неспаренными электронами.
Гомолитическому (радикальному) разрыву подвергаются обычно неполярные или малополярные связи при высокой температуре или облучении.
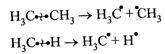
Свободные радикалы существуют доли секунды и далее превращаются в устойчивые конечные продукты.
2. Ионные (гетеролитические) реакции протекают путем гетеролитического разрыва ковалентной связи, когда связующая электронная пара целиком отходит к более электроотрицательному атому:
|
|
|
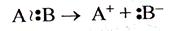
К гетеролитическому разрыву склонны сильнополярные и легкополяризуемые связи, ему способствуют полярные растворители.

Ионы с положительно заряженными атомами углерода называются карбокатионами, а ионы с отрицательно заряженными углеродными атомами – карбанионами.
III. Классификация реакций по характеру атакующего реагента.
Ионные реакции могут быть нуклеофильными или электрофильными.
1. Нуклеофильными (символ N) называются такие реакции, в которых новая ковалентная связь образуется за счет пары электронов нуклеофильного реагента:

2. Электрофильными (символ Е) называются такие реакции, в которых новая ковалентная связь образуется за счет пары электронов углерода реагирующей молекулы (субстрата) с электрофильным реагентом:
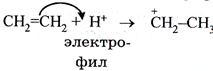
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 484; Нарушение авторских прав?; Мы поможем в написании вашей работы!