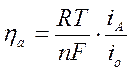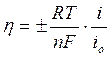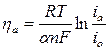КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнения электрохимической поляризации. Теория водородного перенапряжения
|
|
|
|
Рассмотрим электрохимическую кинетику, предполагая, что диффузия протекает значительно быстрее чем электродная реакция (т. е. стадия собственно электрохимическая реакции). Такие условия можно создать за счет достаточно быстрым перемешиванием раствора. (см. рис.).
 Рассмотрим скорость электрохимического процесса (≡ электродного процесса), протекающего на металлическом электроде, погруженном в раствор его собственной соли (см. элемент в начале лекции). При пропускании тока через электрод от в.и.н. величина электродного потенциала отклоняется от равновесного значения
Рассмотрим скорость электрохимического процесса (≡ электродного процесса), протекающего на металлическом электроде, погруженном в раствор его собственной соли (см. элемент в начале лекции). При пропускании тока через электрод от в.и.н. величина электродного потенциала отклоняется от равновесного значения 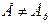 , когда скорость io (окисления) не равна iк (скорости восстановления)
, когда скорость io (окисления) не равна iк (скорости восстановления)

 условие электрохимической поляризации (перенапряжение)
условие электрохимической поляризации (перенапряжение)
Разность этих скоростей и будет общей скоростью процесса 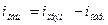
При анодном перенапряжении происходит сдвиг потенциала в положительную область (+ηа), поэтому ионизация Ме на аноде ускоряется, а обратная реакция разряда ионов Ме на катоде замедляется. Таким образом, общая скорость электрохимического процесса равна разности прямой и обратной реакции:

При катодной поляризации (смещение потенциала в отрицательную сторону – ηk) преимущество получит процесс восстановления – разряд ионов Ме из раствора, тогда как обратная реакция окисления – ионизация Ме – замедлится:
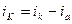
Величина +ηа и – ηk складываются в э.д.с. электрохимической поляризации поляризации или напряжение разложения Еr, которое направлено против э.д.с. элемента и уменьшает ее. Поэтому э.д.с. элемента должна быть увеличена на величину Еr для того, чтобы начался процесс электролиза (см. рис.).
Величина перенапряжения зависит от плотности тока, протекающего через электрод. Причем зависимость эта сложная, если перенапряжение невелико, то η пропорциональна i. Если η большое, то между η и i существует полулогарифмическая зависимость. Рассмотрим оба случая.
1. Если перенапряжение невелико 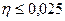 В.
В.
а) Случай анодной поляризации:
 В
В
Тогда

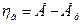
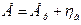 (потенциал электрода смещен в положительную область)
(потенциал электрода смещен в положительную область)
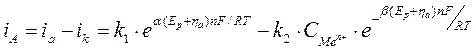
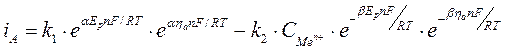
io io

По условию 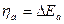 мало (стремится к 0), поэтому обе экспоненциальные функции можно заменить приближенным разложением в ряд Тейлора.
мало (стремится к 0), поэтому обе экспоненциальные функции можно заменить приближенным разложением в ряд Тейлора.
Применение формулы Тейлора для функции  при х = 0
при х = 0

мало (пренебрегаем)
Приближенное разложение в ряд Тейлора
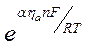
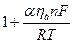
| 
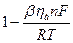
|
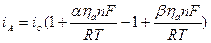
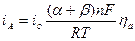 ;
; 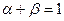
Тогда
|
Видно, что η находится в прямой линейной зависимости от силы тока i и обратно пропорциональна силе тока обмена.
б) при катодной поляризации (перенапряжение):
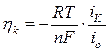
|
где i – поляризующий ток (или общая скорость электрохимического процесса при анодном или катодном перенапряжении);
io – ток обмена на равновесном электроде;
“+” – анодное перенапряжение;
“-” – катодное перенапряжение.
2. Если перенапряжение велико  В.
В.
а) В случае анодного перенапряжения:
Величина сдвига потенциала сильно смещена в положительную область, а, значит, процесс разряда ионов на катоде полностью подавлен, и скорость реакции ионизации будет полностью определять скорость электрохимического процесса в целом:

Решим последнее уравнение относительно сдвига потенциала
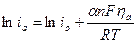
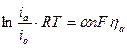
|
Уравнение для процесса анодного перенапряжения (в случае, если 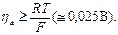 )
)
Этому уравнению часто придают другую форму:
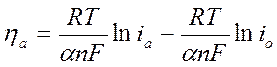

Переведем уравнение в полулогарифмическую форму с учетом lg (десятичного):
 ;
;  ,
,
если Т = 298 К; α = 0,5; n = 1, то b = 0,116, а находят графически
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1069; Нарушение авторских прав?; Мы поможем в написании вашей работы!