
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Построение диаграмм состояния термическим методом
|
|
|
|
Обычно диаграмма состояния строят экспериментальным способом, использую так называемый термический метод. Суть этого метода состоит в следующем: сначала выбирают сплавы различного состава с определённым шагом, например 5, 10, 5 … компонента B. Чем чаще шаг, тем точнее будут исследования. Эти сплавы нагревают до расплавленного состояния и начинают охлаждать на воздухе. При этом через равные промежутки измеряется температура охлаждающих сплавов с помощью термопары. В результате получают серию кривых охлаждения, т.е. графиков зависимости температуры конкретного сплава от температуры.
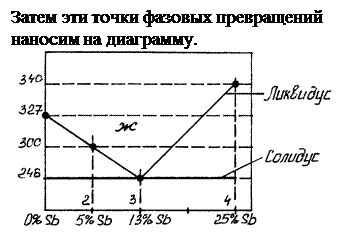
 Угол наклона кривой охлаждения отражает скорость охлаждения сплава. Если угол наклона равен нулю (горизонтальный участок), то скорость охлаждения равна 0. По точкам “перегиба” и точкам остановок, определяют температуры фазовых превращений в сплаве. Так точка T1 соответствует температуре начала кристаллизации сплава, при этом наблюдается уменьшение скорости охлаждения сплава за счёт выделения скрытой теплоты кристаллизации, которая компенсирует отвод тепла от сплава. Параллельно методом рентгеноструктурного анализа и микроскопии определяется структура и фазовый состав конкретных сплавов в определённых температурных интервалов. Затем полученные данные наносят на диаграмму, т.е. для каждого конкретного сплава указываются температуры фазовых превращений и его структура в соответствующих температурных интервалах. Точки однотонных фазовых превращений соединяют линиями. В результате получается диаграмма состояния сплава.
Угол наклона кривой охлаждения отражает скорость охлаждения сплава. Если угол наклона равен нулю (горизонтальный участок), то скорость охлаждения равна 0. По точкам “перегиба” и точкам остановок, определяют температуры фазовых превращений в сплаве. Так точка T1 соответствует температуре начала кристаллизации сплава, при этом наблюдается уменьшение скорости охлаждения сплава за счёт выделения скрытой теплоты кристаллизации, которая компенсирует отвод тепла от сплава. Параллельно методом рентгеноструктурного анализа и микроскопии определяется структура и фазовый состав конкретных сплавов в определённых температурных интервалов. Затем полученные данные наносят на диаграмму, т.е. для каждого конкретного сплава указываются температуры фазовых превращений и его структура в соответствующих температурных интервалах. Точки однотонных фазовых превращений соединяют линиями. В результате получается диаграмма состояния сплава.
Для примера построим диаграмму состояния сплава свинец-сурьма (Pb – Sb). Для этого выберем четырёх конкретных сплава:
|
|
|
1. 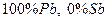
2. 
3. 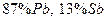
4. 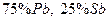

Тема №2: Основные типы диаграмм состояния двух компонентных сплавов.
2.1. Диаграммы состояния для сплавов с неограниченной растворимостью компонентов в твёрдом состоянии.
Рассмотрим двух компонентный сплав A – B, компоненты которого неограниченно растворяются друг в друге, как в жидком, так и в твёрдом состоянии. Неограниченная растворимость в твёрдом состоянии, если: оба компонента имеют одинаковый тип кристаллической решётки, близкий атомный радиус и свойства. Например, золото и платина (Au – Pb), золото-серебро (Au – Ag), медь-никель (Cu – Ni). Диаграмма состояния для таких сплавов имеет следующий вид:
 Ж – область жидкого расплава;
Ж – область жидкого расплава;
α – неограниченный твёрдый раствор: α =a(B)=B(A).
Точка 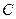 показывает температуру плавления и кристаллизации чистого компонента A. Точка D показывает температуру плавления (кристаллизации) чистого компонента B.
показывает температуру плавления и кристаллизации чистого компонента A. Точка D показывает температуру плавления (кристаллизации) чистого компонента B.
Как видно из диаграммы, компонент  имеет более высокую температуру плавления, чем компонент A.
имеет более высокую температуру плавления, чем компонент A.
Линия CnD является линией ликвидус. Она отражает температуру начала кристаллизации для сплавов различного состава. Выше этой линии сплав любого состава находится в жидком расплавленном состоянии (Ж).
Линия CmD является линией солидус. Она отражает температуры завершения процесса кристаллизации (начала плавления) для сплавов различного состава. Ниже этой линии все сплавы находятся в твёрдом состоянии. В данном случае в виде зерён неограниченно раствора A.
Между линией ликвидус и солидус, сплав находится в двухфазовом состоянии, т.е. состоит из жидкого состава, в котором можно наблюдать кристаллы твёрдого раствора A (Ж+α).
Рассмотрим процесс затвердевания сплава произвольного состава K1. Этому сплаву на диаграмме соответствует вертикальная штрих пунктирная линия. При температурах выше точки 1 – это сплав находится в жидком расплавленном состоянии, т.е. состоит только из одной жидкой фазы – неограниченного жидкого раствора. При температуре соответствующей точке 1, начинается процесс кристаллизации этого сплав. При этом в жидком расплаве появляются зародыши кристаллов твёрдой фазы, неограниченного твёрдого раствора α. По мере уменьшения температуры от точки 1 до точки 2 доля этих кристаллов нарастает, а количество жидкой фазы уменьшается. В точке 2 процесс кристаллизации завершается полным превращением жидкого расплава в кристаллы (зёрна), твёрдой α фазы. Ниже точки 2, и вплоть до комнатной температуры, рассматриваемый расплав является однофазовым, и состоит из зерён лишь одной α - фазы.
|
|
|
Как видно из диаграммы чистые компоненты кристаллизуются (плавятся) строго при фиксированной температуре, а любые сплавы в некотором диапазоне. Кривая охлаждения для чистого компонента выгладит следующим образом.
 То есть при температуре соответствующей температуре точки С наблюдается ступенька. Это обусловлено тем, что при кристаллизации чистого компонента выделяется столько скрытой теплоты, что она полностью компенсирует отвод тепла от охлаждающего материала. В результате, пока идёт процесс кристаллизации, температура материала не меняется. Кривая охлаждения для сплава с концентрацией компонента K1 выглядит следующим образом.
То есть при температуре соответствующей температуре точки С наблюдается ступенька. Это обусловлено тем, что при кристаллизации чистого компонента выделяется столько скрытой теплоты, что она полностью компенсирует отвод тепла от охлаждающего материала. В результате, пока идёт процесс кристаллизации, температура материала не меняется. Кривая охлаждения для сплава с концентрацией компонента K1 выглядит следующим образом.
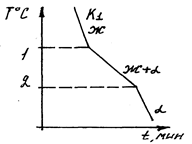 Как видно в 1 и 2 наблюдается “перегиб”, что обусловлено изменением скорости охлаждения сплава в связи с его кристаллизацией.
Как видно в 1 и 2 наблюдается “перегиб”, что обусловлено изменением скорости охлаждения сплава в связи с его кристаллизацией.
В процессе кристаллизации сплав изменяется не только количество твёрдой и жидкой фаз, но также и их химический состав обеих фаз, при любой температуре, можно с помощью правила “отрезков”.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2890; Нарушение авторских прав?; Мы поможем в написании вашей работы!