
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура кипения растворов
|
|
|
|
 Жидкость кипит, когда давление насыщенного пара становится равным внешнему давлению pвн. Так как, по закону Рауля, давление пара над раствором меньше давления пара над чистым растворителем, то температура кипения раствора выше температуры кипения чистого растворителя.
Жидкость кипит, когда давление насыщенного пара становится равным внешнему давлению pвн. Так как, по закону Рауля, давление пара над раствором меньше давления пара над чистым растворителем, то температура кипения раствора выше температуры кипения чистого растворителя.
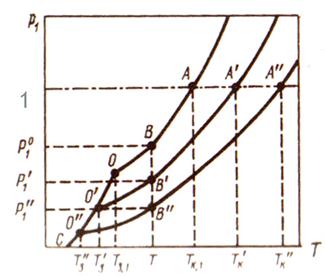
Рис.1. Зависимость давления пара растворителя над раствором и тем-пературы кипения и замерзания раствора от концентрации раство-рённого вещества: ОА - чистый растворитель; О′А′ - разбавленный раствор; О′′А′′ - более концентри-рованный раствор
На рис. 1 кривая ОА описывает зависимость давления пара чистого растворителя от температуры. Когда это давление равно внешнему давлению pвн (на рисунке pвн=1 атм) растворитель закипает при температуре Тк,1. Поскольку при заданной температуре давление пара растворителя в растворах меньше, чем давление пара чистого растворителя, то раствор кипит при более высокой температуре (Тк ′, Тк ′′).
Для разбавленных растворов неэлектролитов повышение температуры кипения раствора по сравнению с чистым растворителем:
DТ=Eb, (7)
где E- эбулиоскопическая постоянная (от ebbulio (лат.)- выкипать), зависящая только от свойств растворителя, К.Кг/моль; b - моляльность.
Докажем выражение (7). Условие кипения:
p1=pоN1=pвн. (8)
или
lnp1=lnpо +lnN1=lnpвн. (9)
При постоянном внешнем давлении из (9) следует:
dlnpо + dlnN1=dlnpвн.=0 (10)
или
dlnpо=-dlnN1=-dln(1-N2). (11)
Для разбавленных растворов N2<<1. Отсюда ln(1-N2)»-N2. Таким образом
dlnpо»dN2 (12)
Зависимость давления насыщенного пара от температуры описывается уравнением Клапейрона -Клаузиуса:
dlnpо/dT=DHисп/RT2. (13)
Из (12,13) следует, что
DHисп/RT2»dN2/dT. (14)
Интегрирование (14) приводит к выражению:
-DHисп /R(1/T-1/Tо)»N2. (15)
|
|
|
Пусть То - температура кипения чистого растворителя. Тогда, приняв, что TоT»Tо2 , получаем
DHисп(T-Tо)/RTо2»N2. (16)
Отсюда
DTкип=T-Tо=N2RTо2/DHисп»(RTо2/DHисп)(n2/n1). (17)
Выражение (17) приводится к виду
DTкип=RTо2n2M1/L1M11000=(RTо2/1000L1)b=Еb, (18)
который получается при условии, что DHисп =LM1, где L1 - удельная теплота испарения растворителя, а n1=1000/M1.
Таким образом
E=RTо2/1000L1. (19)
Температура кипения чистого растворителя имеет определённое значение при фиксированном внешнем давлении. Температура кипения раствора не постоянна - она растёт по мере кипения, так как за счёт испарения растворителя концентрация раствора увеличивается. При этом давление насыщенного пара всё время уменьшается. Температурой кипения раствора принято считать температуру, отвечающую появлению в нём первого пузырька пара.
2.3. Температура замерзания растворов
При равновесном замерзании давления насыщенного пара растворителя над жидкой и твёрдой фазами равны. По закону Рауля над раствором давление пара растворителя ниже давления пара над чистым растворителем. Поэтому при равновесном замерзании раствора давление пара растворителя над твёрдой фазой тоже будет меньше, что возможно лишь при более низкой температуре замерзания раствора по сравнению с температурой замерзания чистого растворителя. Это хорошо видно из рис.1. Понижение температуры замерзания для разбавленных растворов неэлектролитов определяется выражением:
DТ=Kb, (20)
К=RTо2/1000L2, (21)
где Tо, L2 - температура замерзания и удельная теплота плавления чистого растворителя; К - криоскопическая постоянная (от греч. “криос”- холод).
Поскольку с затвердеванием растворителя возрастает концентрация растворённого вещества, то температура замерзания раствора непостоянна и уменьшается в ходе процесса. Поэтому за температуру замерзания раствора принимают температуру образования первого кристаллика.
В табл. 2 приведены значения Е и К для некоторых растворителей.
|
|
|
Таблица 2. Значения Е и К для некоторых растворителей
| Растворитель | Вода | Бензол | Уксусная кислота | Нитробензол |
| Е, К.Кг/моль | 0,516 | 2,57 | 3,1 | 5,27 |
| К, К.Кг/моль | 1,86 | 5,12 | 3,9 | 6,9 |
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2830; Нарушение авторских прав?; Мы поможем в написании вашей работы!