
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Галогенокислоты – твердые бесцветные вещества с низкими температурами плавления
|
|
|
|
Физические свойства
Галогенокислоты – твердые бесцветные вещества с низкими температурами плавления. Могут перегоняться в вакууме. Растворимы в воде. Оказывают прижигающее действие на ткани. Эфиры галогенокислот – ОВ слезоточивого действия.
Оксикислоты – вязкие жидкости или кристаллические вещества с очень высокими температурами плавления и кипения из-за образования водородных связей. При атмосферном давлении не перегоняются, т.к. разлагаются при нагревании. Прекрасно растворимы в воде. Многие представители обладают оптической активностью (существуют в виде оптических изомеров).
Аминокислоты – твердые бесцветные кристаллические вещества с исключительно высокими температурами плавления (2500С и более), что объясняется существованием их в виде внутренних солей.
| Формула | Температура плавления, 0С |
| СH3COOH | 16,6 |
| CH2-COOH NH2 | 233 с разложением |
Фактическое строение (биполярный ион)
O
CH2-C
NH3+ O-
доказано спектральным исследованием (в спектрах не обнаруживается характеристических полос поглощения для групп СООН и NH2).
Аминокислоты не перегоняются даже при глубоком вакууме, плохо растворимы в органических растворителях, хорошо в воде. Многие обладают оптической активностью.
I. Реакции карбоксильной группы
1) Диссоциация в водных растворах (кислотные свойства)
Под влиянием электроотрицательных заместителей в радикале (Гал или группа ОН) кислотные свойства усиливаются.
а) степень диссоциации тем больше, чем большей электроотрицательностью обладает замещающая группа F>Cl>OH.
б) Степень диссоциации тем больше, чем ближе электроотрицательная группа расположена к СООН. Например,
| CH2FCOOH | 2,1.10-2 |
| O CH2OH-C OH | 1,4.10-4 |
| CH2OH-CH2-COOH | 3,0.10-5 |
| CH3COOH | 1,7.10-5 |
|
|
|
Аминокислоты ведут себя иначе. NH2 группа, как мы указывали выше, образует с группой СООН внутреннюю соль, поэтому моноаминокарбоновые кислоты являются веществами нейтральными.
2) Образование солей
Все замещенные кислоты способны образовывать соли с металлами, основаниями, катионами некоторых других солей. Амино- и оксикислоты способны образовывать внутрикомплексные соли с катионами тяжелых металлов.
Эти реакции находят широкое применение в анализе (комплексонометрия, качественная реакция на 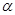 -аминокислоты с Cu(OH)2), в быту (снятие пятен ржавчины), для умягчения воды комплексонами.
-аминокислоты с Cu(OH)2), в быту (снятие пятен ржавчины), для умягчения воды комплексонами.
3) Реакции замещения ОН в карбоксиле, а именно образование сложных эфиров, галогеноангидридов, амидов (см. свойства карбоновых кислот).
II. Реакции Гал, ОН, NH2-групп
1) Галоген, замещенный кислотой, легко вступает в реакции нуклеофильного замещения при действии НОН, NH3, ROH, алкоголятов. Легче идет замещение галогена в 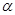 -положении (см. свойства галогенопроизводных).
-положении (см. свойства галогенопроизводных).
2) Группа ОН в оксикислотах может окисляться, дает реакции образования алкоголятов, сложных эфиров, может замещаться на Гал (см. свойства спиртов).
3) Группа NH2 дает реакции алкилирования, ацилирования, взаимодействия с HNO2 (см. свойства аминов).
III. Отличительные реакции замещенных кислот
1) Малая устойчивость к нагреванию
Окси-, аминокислоты и, в некоторых других случаях, галогенокислоты уже при небольшом нагревании претерпевают химические превращения. Типы этих превращений зависят от взаимного расположения функциональных групп.
а) 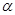 -окси и
-окси и 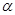 -аминокислоты образуют циклические сложные диэфиры или диамиды при взаимодействии 2-х молекул с отщеплением воды
-аминокислоты образуют циклические сложные диэфиры или диамиды при взаимодействии 2-х молекул с отщеплением воды
O O
CH3-CH-C  CH3-CH-C
CH3-CH-C
OH OH O O
HO OH C-CH-CH3
C-CH-CH3 O
O
молочная кислота лактид
O
CH2-C  CH2-C=O
CH2-C=O
NH2 OH HN NH
HO NH2 C-CH2
C-CH2 O
O
гликокол дикетопиперазин
б) 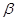 -окси и
-окси и 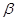 -аминокислоты при нагревании образуют непредельные кислоты, отщепляя воду или NH3.
-аминокислоты при нагревании образуют непредельные кислоты, отщепляя воду или NH3.
|
|
|
кротоновая кислота
Аналогичная реакция может проходить и при нагревании 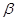 -галогенокислот в присутствии водного раствора щелочи.
-галогенокислот в присутствии водного раствора щелочи.
в) нагревание 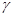 -окси-,
-окси-, 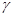 -аминокислот и
-аминокислот и 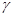 -галогенокислот приводит к образованию циклических сложных эфиров или амидов – лактонов и лактамов
-галогенокислот приводит к образованию циклических сложных эфиров или амидов – лактонов и лактамов
O CH2-CH2
CH3-CH2-CH2-C  CH2 C=O лактон
CH2 C=O лактон
OH O
CH2-CH2-CH2-C=O  CH2-CH2 лактам
CH2-CH2 лактам
NH2 OH CH2 C=O
NH
2) Окисляемость
Оксикислоты и аминокислоты обладают повышенной (по сравнению с карбоновыми кислотами) способностью окисляться.
а) Окисление в щелочной среде идет за счет подвижного атома водорода (OH-)
CH3-CH-COOH + O 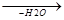 CH3-C-COOH
CH3-C-COOH
OH O
б) Окисление 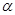 -оксикислот в кислой среде сопровождается расщеплением С-С связи
-оксикислот в кислой среде сопровождается расщеплением С-С связи
H O H O O
CH3-C-C  CH3-C + H-C
CH3-C + H-C  HO-C
HO-C  CO2 + H2O
CO2 + H2O
O-H OH O OH OH
 O OH
O OH
CH3-C
O
3) Разложение замещенных кислот в кислой среде
H H O
CH3-C-COOH  CH3-C + HC
CH3-C + HC  CO + H2O
CO + H2O
OH t O OH
O OH O O O O O
C-CH2-C-CH2-C  C-CH2-C-CH2-C
C-CH2-C-CH2-C  2CO2 + CH3-C-CH3
2CO2 + CH3-C-CH3
COOH OH HO OH
+ HCOOH H2O + CO
H2O + CO
ЛЕКЦИЯ 16
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2392; Нарушение авторских прав?; Мы поможем в написании вашей работы!