
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Побудова ізотерми адсорбції й знаходження величин
|
|
|
|
ЛЕКЦІЯ
ТЕМА 7. ПОВЕРХНЕВІ ЯВИЩА. АДСОРБЦІЯ НА МЕЖІ ПОДІЛУ ФАЗ
Поверхневі явища та їх значення в біології й медицині. Поверхневий натяг рідин і розчинів. Ізотерма поверхневого натягу. Поверхнево-активні та поверхнево-неактивні речовини. Поверхнева активність. Правило Дюкло—Траубе.
Адсорбція на межі поділу рідина—газ та рідина—рідина. Рівняння Гіббса. Орієнтація молекул поверхнево-активних речовин у поверхневому шарі. Уявлення про структуру біологічних мембран. Адсорбція на межі поділу тверде тіло—газ. Рівняння Ленгмюра. Адсорбція з розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. Закономірності адсорбції розчинених речовин, пари та газів. Рівняння Фрейндліха.
Фізико-хімічні основи адсорбційної терапії (гемосорбція, плазмосорбція, лімфосорбція, ентеросорбція, аплікаційна терапія). Імуносорбенти.
Адсорбція електролітів: вибіркова та йонообмінна. Правило Панета—Фаянса. Йонообмінники природні та синтетичні. Роль адсорбції та йонного обміну в процесах життєдіяльності рослинних і тваринних організмів.
Хроматографія. Класифікація хроматографічних методів аналізу за ознакою агрегатного стану фаз, техніки виконання та механізму розподілу. Застосування хроматографії в біології та медицині.
ПОВЕРХНЕВІ ЯВИЩА ТА ЇХ ЗНАЧЕННЯ В БІОЛОГІЇ Й МЕДИЦИНІ. ПОВЕРХНЕВИЙ НАТЯГ РІДИН І РОЗЧИНІВ. ІЗОТЕРМА ПОВЕРХНЕВОГО НАТЯГУ. ПОВЕРХНЕВО-АКТИВНІ ТА ПОВЕРХНЕВО-НЕАКТИВНІ РЕЧОВИНИ. ПОВЕРХНЕВА АКТИВНІСТЬ. ПРАВИЛО ДЮКЛО—ТРАУБЕ
Виникнення поверхневих явищ зумовлено силами міжмолекулярної взаємодії, котрі особливо яскраво виявляються на міжфазних межах поділу.
Адсорбцією називається концентрування газоподібної або розчиненої речовини на поверхні роздягнула фаз.
|
|
|
Розрізняють поняття: сорбція, адсорбція, абсорбція.
Сорбція - поглинання якою-небудь речовиною інших речовин.
Адсорбція - протікання процесу сорбції тільки на поверхні, збільшується концентрація речовини на границі роздягнула фаз.
Абсорбція - поглинання речовини всім об'ємом іншої речовини. При абсорбції поглинається речовина, що, дифундує вглиб абсорбенту
Речовина, на поверхні якого йде адсорбція, називається адсорбентом, тобто адсорбент - це речовина, що адсорбує інша речовина.
Речовина, що адсорбується, називається адсорбтивом або адсорбатом.
Розрізняють адсорбцію фізичну й хімічну.
Фізична адсорбція забезпечується силами Ван-дер-Ваальса, протікає мимовільно, молекули адсорбтива можуть переміщатися по поверхні (нелокалізована адсорбція), характеризується оборотністю, відсутністю стехіометричних співвідношень, зменшенням адсорбції при підвищенні температури, супроводжується десорбцією. Процеси адсорбції й десорбції перебувають у рівновазі: адсорбція «десорбція.
Хімічна адсорбція або хемосорбція обумовлена хімічною взаємодією адсорбенту з адсорбтивом. Молекули адсорбтива не можуть переміщатися по поверхні адсорбенту. Необоротна. Тепловий ефект близький до енергії утворення хімічних сполук. Підвищення температури сприяє хемосорбції.
Адсорбцію найчастіше характеризують залежністю кількості речовини, що адсорбується а від концентрації або тиску 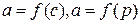 при Т = соnst. Ці залежності називаються ізотермами адсорбції (рис. 1).
при Т = соnst. Ці залежності називаються ізотермами адсорбції (рис. 1).
На ізотермі можна виділити три ділянки: 1-й - адсорбція пропорційна концентрації речовини; 3-й ділянка - поверхня насичена адсорбтивом; 2-й ділянка - проміжний стан.
Ізотерма адсорбції по виду нагадує параболу.
 |
Рис.1 Ізотерми адсорбції
Розрізняють адсорбцію на поверхні роздягнула наступних фаз:
|
|
|
1) газ - тверде тіло;
2) газ - розчин;
3) тверде тіло - розчин;
4) адсорбція на поверхні двох рідин, що не змішуються (рідина - розчин).
АДСОРБЦІЯ. ІЗОТЕРМА АДСОРБЦІЇ. РІВНЯННЯ ГІББСА.
ПН розчинів звичайно відрізняється від ПН розчинника.
Розчинена речовина може не змінювати  , підвищувати й знижувати його.
, підвищувати й знижувати його.
Поверхнева вільна енергія прагне до мінімуму, тому при підвищенні 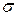 речовина буде віддалятися з поверхні усередину рідини. Повному видаленню молекул розчиненої речовини з поверхні перешкоджає тепловий рух, під дією якого речовина прагне до рівномірного розподілу в об'ємі.
речовина буде віддалятися з поверхні усередину рідини. Повному видаленню молекул розчиненої речовини з поверхні перешкоджає тепловий рух, під дією якого речовина прагне до рівномірного розподілу в об'ємі.
Під впливом цих двох факторів установлюється рівновага, у результаті якого концентрація речовини в поверхневому шарі зменшується в порівнянні з концентрацією в об'ємі.
Якщо розчинена речовина знижує 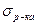 , то концентрація його в поверхневому шарі збільшується.
, то концентрація його в поверхневому шарі збільшується.
Мимовільна зміна концентрації речовини в поверхневому шарі, віднесене до одиниці поверхні, називається адсорбцією, позначається через Г и виражається в кмоль/м2, або моль/см2.
Якщо Г>0 адсорбцію називають позитивною, якщо Г<0 - негативної.
Якщо розчинена речовина не змінює 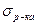 , адсорбція Г=0 і речовина рівномірно розподілена між поверхневим шаром і об'ємом.
, адсорбція Г=0 і речовина рівномірно розподілена між поверхневим шаром і об'ємом.
Просте термодинамічне співвідношення між поверхневою концентрацією Г и зміною ПН із активною концентрацією речовини, що  розчиняється, було виведено Гіббсом:
розчиняється, було виведено Гіббсом:
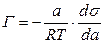
де:  - активність розчину;
- активність розчину;
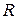 - універсальна газова постійна;
- універсальна газова постійна;
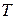 - абсолютна температура.
- абсолютна температура.
Для розведених розчинів активність заміняють концентрацією С:
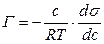
З рівняння випливає, що тільки ті речовини показують позитивну адсорбцію, з підвищенням концентрації яких ПН знижується, 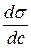 <0.
<0.
Якщо 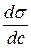 >0, концентрація розчиненої речовини в поверхневому шарі буде зменшуватися: Г<0.
>0, концентрація розчиненої речовини в поверхневому шарі буде зменшуватися: Г<0.
Речовини, що підвищують ПН, називаються негативно поверхнево-активними речовинами (інактивними, ними є неорганічні солі).
Речовини, що знижують ПН називають поверхнево-активними (ПАР)
ДО ПАР відносяться органічні речовини, молекули яких побудовані з ділянок з різко, що розрізняються властивостями. Одна частина молекули полярна, інша - неполярна (вуглеводний радикал).
Полярна: -OH, -COOH, -SO3Na, -SO3H, -NH2, -SO2H.
Полярна частина гідрофільна, неполярна - гідрофобна.
|
|
|
ПАР характеризуються величиною ГЛБ (гідрофільно-ліпофільного балансу).
Величина 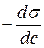 , згідно Ребіндеру, є мірою здатності речовини знижувати поверхневу енергію, вона називається поверхневою активністю й позначається
, згідно Ребіндеру, є мірою здатності речовини знижувати поверхневу енергію, вона називається поверхневою активністю й позначається  . Її розмірність - Н/м.
. Її розмірність - Н/м.
У гомологічному ряді жирних кислот, спиртів і амінів зниження 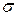 тим більше, чим довше ланцюг.
тим більше, чим довше ланцюг.
Відповідно до правила Дюкло-Траубе, при подовженні ланцюга на групу СН2 поверхнева активність  зростає на границі розчин-повітря в 3-3,5 разів.
зростає на границі розчин-повітря в 3-3,5 разів.
Для визначення цієї характеристики будують залежність 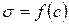 . Використовуючи рівняння Гіббса, будують залежність
. Використовуючи рівняння Гіббса, будують залежність  .
.
Ізотерма адсорбції описується рівнянням Ленгмюра:

де:  – гранична концентрація речовини, адсорбованого на 1 м2 поверхні, кмоль/м2;
– гранична концентрація речовини, адсорбованого на 1 м2 поверхні, кмоль/м2;
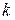 - константа рівноваги, рівна відношенню констант швидкостей процесів десорбції й адсорбції.
- константа рівноваги, рівна відношенню констант швидкостей процесів десорбції й адсорбції.
Знаючи Г можна розрахувати площа S, що доводиться на 1 молекулу.
Число адсорбованих молекул на 1 м2 становить:
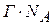 .
.
Звідси:  .
.
Зі збільшенням Г величина S зменшується й при  досягає мінімального значення
досягає мінімального значення 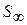 :
:
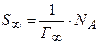 .
.
Користуючись  обчислюють товщину
обчислюють товщину 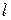 насиченого поверхневого шару:
насиченого поверхневого шару:
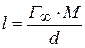 ,
,
де: 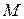 - молекулярна маса;
- молекулярна маса;
 - густина адсорбованої речовини.
- густина адсорбованої речовини.
Будують ізотерму ПН (залежність 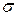 від концентрації ПАР).
від концентрації ПАР).
По ізотермі ПН розраховують Г по рівнянню Гіббса.
Для цього до кривої 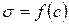 в декількох крапках проводять дотичні до перетинання їх з віссю ординат, проводячи також паралельні прямі до перетинання з віссю ординат (рис. 6.5). Із трикутника АВ знаходять
в декількох крапках проводять дотичні до перетинання їх з віссю ординат, проводячи також паралельні прямі до перетинання з віссю ординат (рис. 6.5). Із трикутника АВ знаходять 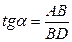 або
або 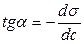 . Знаходять кілька значень
. Знаходять кілька значень 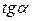 для C1, C2, C3, і будують залежність
для C1, C2, C3, і будують залежність .
.

Рис. 2 Побудова ізотерми адсорбції по ізотермі поверхневого натягу
Кожної концентрації С відповідає відрізок Z на осі ординат.
Довжина відрізка, виражена в одиницях ПН дорівнює: 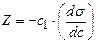 , тому що відповідно до побудови
, тому що відповідно до побудови 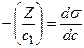 .
.
Підставивши отримані значення Z у рівняння:
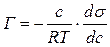 ,
,
одержимо:
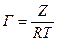 .
.
Використовуючи Z для ряду концентрацій, розраховують адсорбцію Г.
Будують ізотерму адсорбції, відкладаючи по осі абсцис ІЗ, а по осі ординат Г.
Значення  визначають графічно по рівнянню Ленгмюра, перетворивши його в рівняння прямої лінії (рис. 4.3):
визначають графічно по рівнянню Ленгмюра, перетворивши його в рівняння прямої лінії (рис. 4.3):
|
|
|

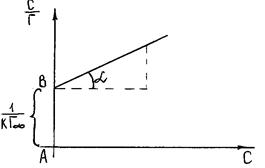
Рис. 3 Графік рівняння Ленгмюра в прямолінійних координатах
Кут  на рис. 4.3 дозволяє визначити
на рис. 4.3 дозволяє визначити  :
: 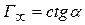 .
.
Відрізок 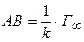 .
.
Із цього рівняння визначаємо 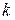 .
.
З рівняння  обчислюємо
обчислюємо 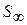 й
й 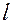 з рівняння
з рівняння 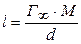 .
.
АДСОРБЦІЯ НА МЕЖІ ПОДІЛУ РІДИНА—ГАЗ ТА РІДИНА—РІДИНА. РІВНЯННЯ ГІББСА. ОРІЄНТАЦІЯ МОЛЕКУЛ ПОВЕРХНЕВО-АКТИВНИХ РЕЧОВИН У ПОВЕРХНЕВОМУ ШАРІ. УЯВЛЕННЯ ПРО СТРУКТУРУ БІОЛОГІЧНИХ МЕМБРАН. АДСОРБЦІЯ НА МЕЖІ ПОДІЛУ ТВЕРДЕ ТІЛО—ГАЗ. РІВНЯННЯ ЛЕНГМЮРА. АДСОРБЦІЯ З РОЗЧИНУ НА ПОВЕРХНІ ТВЕРДОГО ТІЛА. ФІЗИЧНА ТА ХІМІЧНА АДСОРБЦІЯ.
ЗАКОНОМІРНОСТІ АДСОРБЦІЇ РОЗЧИНЕНИХ РЕЧОВИН, ПАРИ ТА ГАЗІВ.
Поверхневий натяг є наслідком існування внутрішнього тиску - сили молекули, що втягує, усередину рідини і спрямованої перпендикулярно поверхні. Внутрішній тиск тим вище, чим полярніше речовина, так що причиною його є дія молекулярних сил.
При розгляді поверхневого натягу на границі рідина-газ або рідина-пара, внаслідок великої розрідженості газу або пари, взаємодією між молекулами рідини й газу або пари можна зневажити. Цього не можна зробити у випадку поверхневого натягу на границі рідина-рідина. Наявність над першою рідиною шару іншої, що не змішується з нею рідини приводить до зниження міжфазного поверхневого натягу, оскільки молекули другої рідини притягають до себе молекули першої й таким чином, зменшують дія некомпенсованих сил на поверхні першої рідини.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5768; Нарушение авторских прав?; Мы поможем в написании вашей работы!