
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №25
Тема: Квантово-механическая модель атома. Квантовые числа. Принцип Паули. Электронные оболочки. Застройка электронных оболочек. Периодическая система элементов Д.И.Менделеева. Рентгеновские лучи.
Строение электронной орбитали и ее энергия взаимодействия с ядром атома определяются атомными квантовыми числами, которые являются целочисленными параметрами собственных функций уравнения Шредингера. Квантовые числа называются: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n характеризует уровень энергии электрона и удаленность последнего от ядра атома. Сейчас известны следующие значения главных квантовых чисел и соответствующие им энергетические уровни атомов:
Главное квантовое число 1,2,3,4,5,6,7,8.
Энергетический уровень K, L, M, N, O, P, Q, R.
Энергия уровней возрастает с ростом главного квантового числа: наименьшим значением энергии обладает уровень К (n =1), ближайший к ядру атома.
Орбитальное квантовое число l определяет момент количества движения, электрона относительно ядра атома. Значения l изменяются от 0 до (n -1). Как и главное квантовое число n, орбитальное квантовое число тоже определяет энергию электрона, но уже в определенном энергетическом уровне. Следовательно, электроны с одинаковым n, но разным орбитальным квантовым числом, могут обладать различной энергией и занимать на одном и том же уровне различные энергетические подуровни. Однако разница энергий с n = 1 и n = 2 значительно больше, чем разница энергий подуровней с l =0 и l =1. В зависимости от величины l подуровни обозначаются такими буквами:
Значение l 0, I, 2, 3,. 4.
Обозначение подуровня s, p, d, f, g.
Самым главным свойством орбитального квантового числа является то, что оно определяет форму электронной орбитали, которая обозначается так же, как и подуровни.
Энергия связи электрона в атоме с ростом радиуса энергетического уровня, на котором он находится, очень быстро уменьшается, наиболее связанные с ядром будут электроны с минимальным n. С ростом l энергия электрона тоже уменьшается. Например,2sэлектрон связан с ядром атома крепче, чем 2р электрон.
Пока главное квантовое число мало, различия в энергии, вызванные изменением l, малы по сравнению с различиями, связанными с изменением n. Однако положение меняется, если n >3. Например, энергия орбитали 4s меньше энергии орбитали 3d.
Таким образом, квантовые числа n и l определяют энергию и форму электронных орбиталей.
Магнитное квантовое число me определяет момент количества движения электрона относительно внешнего электромагнитного поля. Оно может принимать значения от l до - l или всего (2 l + I) значений.
Количество магнитных квантовых чисел определяет число электронных орбиталей:
электронная орбиталь s, p, d, f, g.
величина l 0, I,2, 3, 4.
количество me = (2 l + I) I. 3. 5. 7. 9.
Расщепление энергетических уровней в магнитном поле обнаружено Земаном, а в электрическом поле Штарком.
Магнитное спиновое квантовое число ms. Спин характеризует собственный момент количества движения электрона вокруг своей оси. Существуют всего две независимые возможности такого вращения: против часовой стрелки и по часовой стрелке. Им отвечают два значения магнитного спинового квантового числа: ms = +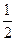 и ms= -
и ms= -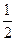 . Расщепление соответствующих уровней подтверждено в опытах О. Штерна и В. Герлаха.
. Расщепление соответствующих уровней подтверждено в опытах О. Штерна и В. Герлаха.
Значит, эти четыре квантовых числаn, l, me, ms определяют энергию и положение электрона в атоме.
|
|
Дата добавления: 2014-01-07; Просмотров: 243; Нарушение авторских прав?; Мы поможем в написании вашей работы!