
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические превращения моносахаридов in vivo
|
|
|
|
Н- С-ОН d Н- С-ОН d Н- С-ОН d Н- С-ОН d
Н-С-ОН d Н-С-ОН d Н-С-ОН d Н-С-ОН d Н-С-ОН d
| | | | |
5 СН2 ОН СН2 ОН СН2 ОН СН2 ОН СН2 ОН
D-рибулоза(dd)
D - рибоза (d d d) D- ксилоза (d l d) D- арабиноза(d d l) D - 2- дезоксирибоза
Два природных углевода, которые имеют общую кетозу, являются эпимерами, в слабо щелочном растворе превращаются друг в друга; процесс превращения называется - эпимеризацией (в терминах стереоизомерии- эпимеры- диастереомеры)
D- Рибоза (d d d) <——> D-рибулоза(d d) <——> D-арабиноза (d d l)
В более широком понимании- эпимеры- диастереомеры, отличающиеся конфигурацией только одного хирального центра.
Гексозы
Состав гексозы С6(Н2О)6 или С6 Н12О6.
Различают два вида гексоз: альдозы и кетозы
Альдозы содержат четыре хиральных атома, и образуют 16 стереоизомеров.(восемь принадлежат D- ряду, восемь L – ряду)
В биологическом отношении наиболее важное значение для организма человека имеют три альдозы D- стереоряда: D- глюкоза (d d l d), D- манноза (d d l l),
D – галактоза. (d l l d) и кетоза D – фруктоза (d d l).
1СНО СНО СНО СН2 ОН
| | | |
Н –С-ОН d НО –С-Н l Н –С-ОН l С=О
| | | |
НО-С-Н l НО-С-Н l Н-С-ОН d НО- С- Н l
| | | |
Н-С-ОН d Н-С-ОН d НО-С- Н l Н-С-ОН d
| | | |
| | | |
6СН2 ОН СН2 ОН СН2 ОН СН2 ОН
D- глюкоза (d d l d) D- манноза (d d l l) D– галактоза (d l l d) D– фруктоза (d d l).
Все перечисленные три альдогексозы- диастереомеры (эпимеры).
Химические свойства моносахаридов
Знание химических свойств моносахаридов необходимо для понимания путей превращения этих важнейших биоактивных соединений в организме и участия их в метаболических процессах.
1. цикло-оксотаутомерия (кольчато-цепная таутомерия) и мутаротация
2. изомеризация, эпимеризация
3. образование аминогруппы у атома С 2.
4. образование гликозидов
5. образование сложных эфиров
6. реакции окисления
7. реакции восстановления
Изомеризация, эпимеризация
Две альдогексозы глюкоза и манноза связаны взаимными неферментативными превращениями в растворе (способствует слабощелочная среда): эпимеры отличаются конфигурацией у второго атома углерода и превращаются друг в друга и в общую кетозу - фруктозу.
D- глюкоза (d d l d ) <——> D – фруктоза (d d l) <——> D- манноза (d d l l )
В клетках человека эти превращения катализируются ферментами, взаимное превращение фосфорных эфиров глюкозы и фруктозы- одна из реакций гликолиза.
Превращение двух других эпимеров: глюкозы и галактозы, которые отличаются конфигурацией третьего атома углерода, спонтанно невозможно.
галактоза (d l l d) <—х—> глюкоза (d d l d)
Это сложный ферментативный процесс и в растворе углеводов in vitro не происходит.
Цикло-оксотаутомерия
Моносахариды существуют в форме альдегидов (кетонов) и циклических внутренних
полуацеталей (полукеталей).
Присутствие двух групп - карбонильной и гидроксильной - в молекуле моносахарида делает возможным протекание внутримолекулярной реакции нуклеофильного присоединения А N, которая сопровождается образованием циклического полуацеталя
(полукеталя).
полуацетальный (гликозидный)
гидроксил
H Н
| |


 ——С= О ——— *С — ОН атом углерода хиральный
——С= О ——— *С — ОН атом углерода хиральный


 <———> возникают 2 зеркальных
<———> возникают 2 зеркальных
А N изомера
————— О — Н ——— О
циклическая форма (полуацеталь)
Два процесса приводят к образованию циклического соединения:
А) нуклеофильная атака кислорода по атому углерода карбонильной группы
Б) атом водорода присоединяется к кислороду карбонильной группы
Появляется спиртовая группа вместо карбонильной.
Возникают два зеркальных изомера, т.к. возникает новый хиральный центр. Такие зеркальные циклические изомеры называются аномерами.
Гидроксильная полуацетальная группа в аномерном центре углевода в циклической форме называется гликозидной, аномерной.
Пятичленные формы носят название фуранозы (фуранозные циклы) (по аналогии с пятичленным циклическим соединением фураном)
Н ОН НО Н
 \ / \ /.
\ / \ /.
С С

 / \ / \
/ \ / \
цикл цикл
Зеркальная изомерия циклической формы моносахарида
(аномерные гидроксигруппы выделены жирным шрифтом)
Шестичленные циклы носят название пиранозы (пиранозные циклы)
Все альдопентозы: рибоза, дезоксирибоза и др. и кетогексоза фруктоза in vivo
присутствуют в форме фуранозы (in vitro возможно образование и пиранового цикла). Фуранозный цикл плоский.
Альдогексозы глюкоза, галактоза, манноза образуют in vivo шестичленные пирановые циклы. Пиранозный цикл может быть, как и циклогексан, в двух пространственных формах: кресло и ванна. В природных соединениях пиранозные циклы имеют конформацию кресло. Пиранозные циклы более устойчивы к размыканию по сравнению с фуранозными
Схема циклизации
В циклической и нециклической форме число гидроксильных групп одинаковое, но в циклической форме исчезает карбонильная группа. Вместо нее образуется гидроксильная группа, которую называют полуацетальной (гликозидный гидроксил). Два зеркальных циклических изомера по атому углерода С1 обозначают двумя символами- а- и β.
Два циклических изомера моносахарида, отличающихся только пространственным расположением полуацетального гидроксила, носят название аномеров: а-аномер и
Β- аномер (см. схему циклизации). Циклические формы моносахаридов записывают, используя два различных вида структурных формул: Колли- Толленса (применяются сейчас крайне редко) и Хеуорса.
Формулы Колли- Толленса образуются из проекций Фишера, в настоящее время они применяются крайне редко, но зато поясняют, как происходит циклизация. От формулы Колли-Толленса, зная особые правила, легко перейти к формуле Хеуорса.
Цикло –оксотаутомерия гексоз.
Глюкоза
    | | | |
 Н О-1С-Н Н - С = О Н - 1С -ОН Н О-1С-Н Н - С = О Н - 1С -ОН
 | | |
Н -2C- ОН Н -C- ОН Н -C- ОН
| | | | | |
Н -2C- ОН Н -C- ОН Н -C- ОН
| | |
  НО-3С-Н О НО-С-Н НО-С-Н О
| | |
Н -4C- ОН Н -C- ОН Н -C- ОН НО-3С-Н О НО-С-Н НО-С-Н О
| | |
Н -4C- ОН Н -C- ОН Н -C- ОН
 | | | | | |
   Н -5C Н-С-ОН Н-С | | | |
СН2 ОН СН2 ОН СН2 ОН
А Б
β- аномер а-аномер
β – D- глюкопираноза а- D -глюкопираноза Н -5C Н-С-ОН Н-С | | | |
СН2 ОН СН2 ОН СН2 ОН
А Б
β- аномер а-аномер
β – D- глюкопираноза а- D -глюкопираноза
|
У атома С1 возникает гидроксильная группа- полуацетальный, гликозидный гидроксил. (на схеме формулы А и Б, гидроксильная группа выделена жирным шрифтом)
В циклических формах атом С1 тетраэдрический, связан с четырьмя разными группировками, возникает новый хиральный центр, который обусловливает существование двух изомеров- а- и β-аномеров. Атом С1 принято называть «аномерным»
Аномер, в котором полуацетальный гидроксил расположен также, как гидроксильная группа, определяющая стереоряд (справа от оси молекулы), является а-аномером; если полуацетальный гидроксил расположен по другую сторону (слева) - β-аномер.
Для построения формул Хеуорса следует нарисовать шестичленный цикл, поставить циклический атом кислорода в определенном месте (правый верхний угол, это положение не нумеруется), нарисовать вертикальные связи у каждого атома углерода и те группы, которые в формуле Колли-Толленса были справа (d- конфигурация), написать под плоскостью цикла, а те, что были слева (l- конфигурация), написать над плоскостью цикла.
Упрощенное правило: что справа -то внизу, что слева – то вверху (удобно запомнить, в каждой паре двух слов одна буква «р»).
На рисунке изображена а –D - глюкопираноза (формула Хеуорса)
 d
d  полуацетальный
полуацетальный
l d гидроксил в а-форме направлен «вниз»
На следующем рисунке представлены оксоформа D-галактозы и циклоформа: а –D
глюкопираноза.(внимательно рассмотрите и сравните расположение всех гидроксигрупп в обеих формулах и гликозидного гидроксила)

 d
d 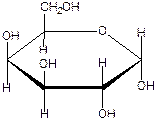 полуацетальный
полуацетальный
D – галактоза (d l l d) l d гидроксил
а- D- галактопираноза
Альдопентозы и кетогексозы в биологических соединениях образуют фуранозные пятичленные циклы. Все ранее отмеченные особенности и правила записи формулы Хеурса сохраняются.

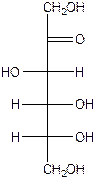
 β - полуацетальный
β - полуацетальный
D- фруктоза (d d l) d l гидроксил
β - D- фруктофураноза
Во всех природных соединениях: нуклеотидах, нуклеиновых кислотах, АТФ, рибоза и дезоксирибоза находятся только в β - аномерной фуранозной форме, что увеличивает внутренний запас энергии соединения и его реакционную способность.
Образование фосфорных эфиров
Все моносахариды в клетке существуют в виде фосфорных эфиров, которые образуются в ферментативных реакциях с участием АТФ
Рибоза + АТФ ———> рибозо -5- фосфат
Глюкоза + АТФ ———> глюкозо -6- фосфат
Галактоза + АТФ ———> галактозо -6- фосфат
Возможен перенос фосфатной группы из одного положения в другое в обратимой реакции изомеризации
Глюкозо-6-ф <———> Глюкозо-1-ф (аномеры а и β)
Фосфорные эфиры гидролизуются in vitro и in vivo
Глюкозо-6-фосфат + Н2О ———> глюкоза + Н3 РО4
Образование гликозидов
Моносахариды в циклической форме образуют гликозиды.
Различают:
О-гликозиды (атом водорода в гликозидном гидроксиле заменен на радикал,
гидрокси группа замещается на остаток спирта)
N- гликозиды (вместо группы ОН атом С 1 связан с атомом азота.
S - гликозиды (вместо группы ОН атом С 1 связан с атомом серы)
Гликозиды распространены в природе. Гликозидами являются нуклеотиды, олиго- и полисахариды. Гликозиды образуются при обезвреживании эндогенных токсических веществ организма(билирубина) и экзогенных токсинов и лекарственных препаратов.
Гликозидная связь устойчива в слабощелочной среде и легко гидролизуется в кислой.




 О-Н О - R
О-Н О - R


 О О агликон
О О агликон
 + R- О- Н ——> + Н2 О
+ R- О- Н ——> + Н2 О
 |
Н Н
β - Пираноза
О О- β- гликозид - ( О - β- пиранозид)
Неуглеводная часть (радикал) в гликозиде называется агликон. В природе в растениях часто в качестве агликона встречаются многоатомные фенолы, флавоноиды. Такие соединения могут обладать различными лекарственными свойствами: сердечные гликозиды, антиоксиданты, противолучевые средства, могу быть токсическими соединениями(дигиталис- гликозид, выделяемый из наперстянки)
Реакции восстановления
При восстановлении альдоз и кетоз образуются многоатомные спирты- глициты.
Ферментативное восстановление in vivo происходит с участием НАДН + Н+.
D- Глюкоза (ddld) + 2Н <——> сорбит (ddld)
(С6 Н12 О6) (С6 Н14 О6)
В организме
Гл-6-фосфат + НАДН + Н+ <——> 6-ф- сорбит + НАД+
Реакции взаимного превращения моносахаридов и глицитов протекают в организме человека. При накоплении глюкозы в крови (например, в случае диабета - тяжелого
распространенного заболевания эндокринной системы) образуется сорбит, который накапливается в тканях, камере глаза, вызывая повышение осмотического давления, что является одной из причин нарушения зрения при диабете.
Многоатомные спирты ксилит, маннит используются как лекарственные средства.
Реакции окисления моносахаридов
Известны три направления окисления альдоз.
А) Гликоновые (альдоновые) кислоты
При окислении альдегидной группы образуются гликоновые(альдоновые) кислоты, которые по классификации не относятся к углеводам - это полигидроксикарбоновые кислоты. Окислению подвергается не карбонильная(оксо) форма, а циклическая, в виде полуацеталя и образуется циклический эфир кислоты – лактон.
Напишем реакцию окисления в традиционном виде(в разомкнутой оксо – форме). Для окисления in vitro используют раствор бромной воды (бромноватистую кислоту)
Вг2 + Н2О ——> НВг + НОВг
СН2 – (СН2)4– СНО + НОВг ——> СН2 – (СН2)4– СООН + НВг
| | | |
ОН ОН ОН ОН
глюкоза глюконовая кислота
а - D- глюкопираноза окисляется медленнее, чем β – аномер.
Для качественного обнаружения альдоз применяют реакцию окисления с реактивами Бенедикта, Толленса, Фелинга, реакция проходит в щелочной среде.
Фруктоза вследствие изомеризации в щелочной среде в альдозу также дает положительную реакцию, характерную для альдоз (ложная реакция, не позволяет провести избирательное определение глюкозы в присутствии фруктозы)
Альдаровые (гликаровые, сахарные) кислоты
При действии на альдозы азотной кислотой образуются гликаровые (сахарные) кислоты, которые являются полигидроксидикарбоновыми кислотами. Они не являются
углеводами. поскольку потеряли карбонильную группу.
Сахарные кислоты встречаются в природе, в частности, винные кислоты относятся к сахарным.
НNO3
СН2 – (СН2)4– СНО ——> НООС – (СН2)4– СООН
| | |
ОН ОН ОН
Гексоза гликаровая (сахарная) кислота
К названию углевода добавляют «аровая кислота» или «сахарная кислота». Многие имеют тривиальные названия. При окислении глюкозы образуется глюкаровая кислота. Названия глюкаровая кислота и сахарная кислота однозначны.
НNO3
Галактоза ——> галактаровая кислота (галактосахарная, слизевая.)
Слизевая кислота была выделена из виноградных улиток.
Винные кислоты относятся к аровым кислотам.
В) Альдуроновые (гликуроновые) кислоты.
Это моносахариды: они сохраняют карбонильную группу, а последняя в углеродном скелете первичная гидроксильная группа окислена до карбоксильной. Гликуроновые кислоты склонны к цикло-оксотаутомерии и in vivo образуют гликозиды в β – аномерной форме пиранозы.
Наибольшее распространение имеет D- глюкуроновая кислота Ее биологическая роль: -участвует в обезвреживании токсических соединений, образующихся в организме или попадающих извне(ксенобиотиков)
- входит в состав гетерополисахаридов, образующих межклеточное вещество соединительной ткани.
Для получения глюкуроновой кислоты необходимо защитить альдегидную группу от окисления, с этой целью используют гликозиды β – D- глюкопиранонозы, после окисления спиртовой группы проводят гидролиз гликозидной связи.
СНО
|
Н-С-ОН d
|
НО- С-Н l
|
Н- С-ОН d
|
Н-С-ОН d
|
СООН
глюкуроновая кислота
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2492; Нарушение авторских прав?; Мы поможем в написании вашей работы!