
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость химической реакции
|
|
|
|
| Увеличивают скорость | Уменьшают скорость |
| Наличие химически активных реагентов | Наличие химически неактивных реагентов |
| Повышение концентрации реагентов | Понижение концентрации реагентов |
| Увеличение поверхности твердых и жидких реагентов | Уменьшение поверхности твердых и жидких реагентов |
| Повышение температуры | Понижение температуры |
| Присутствие катализатора | Присутствие ингибитора |
Вопросы для закрепления темы:
1. Что называется скоростью реакции?
2. Как определяется скорость химической реакции?
3. Какие факторы влияют на скорость реакции?
4. Что называется катализатором?
5. Что называется ингибитором?
6. В чем суть правила Вант-Гоффа?
7. Что показывает температурный коэффициент?
8. Что называется энергией активации?
9. В чем суть закона действующих масс для скорости реакции?
10. Что называется гомогенной реакцией?
11. Что называется гетерогенной реакцией?
Лекция № 6: Химическое равновесие. Смещение химического равновесия. Принцип Ле Шателье. Константа равновесия.
Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которых далее уже не меняется со временем. Например, при нагревании происходят следующие превращения:
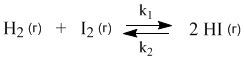
У этой равновесной системы есть замечательное свойство: ее состав не зависит от способа получения. Можно нагревать смесь газообразных водорода и йода, а можно взять для опыта чистый HI – результат будет одним и тем же: образуется равновесная смесь трех веществ (H2, I2, HI) одного и того же состава. Для внешнего наблюдателя в такой системе химические превращения не происходят, но на самом деле здесь постоянно идут прямая и обратная реакции. Рассмотрим эту систему с точки зрения химической кинетики.
Допустим, для опыта взяли газообразные водород и йод. В первый момент времени еще нет HI, поэтому идет только прямая реакция, скорость которой (v пр) выражается кинетическим уравнением:
v пр = k1[H2][I2]
Здесь k1 – константа скорости прямой реакции. Постепенно в смеси накапливается продукт реакции HI. Но в этих же условиях йодистый водород с заметной скоростью разлагается на исходные вещества: H2 и I2. Скорость обратной реакции (v обр) выражается кинетическим уравнением с константой скорости k2:
v обр = k2[HI]2
Когда йодистого водорода образуется уже достаточно много (т.е. когда его концентрация достигнет определенной величины), скорости прямой и обратной реакции выравниваются:
v пр = v обр
В этом случае говорят, что наступило химическое равновесие. Количество содержащихся в равновесной системе веществ H2, I2 и HI теперь не меняется со временем, если нет внешних воздействий на систему.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1608; Нарушение авторских прав?; Мы поможем в написании вашей работы!