
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ненасыщенные углеводороды
|
|
|
|
АЛКЕНЫ.
Общая формула СnH2n.
Алкены (этиленовые) – углеводороды, в молекулах которых имеется двойная связь. Атомы углерода, связанные двойной связью находятся в состоянии гибридизации sp2, то есть только 3 электрона внешней оболочки участвуют в образовании гибридных орбиталей (например, в молекуле этилена гибридные орбитали образуют σ-связи между атомами углерода и между углеродом и водородами). Все σ-связи углеродов, связанных двойной связью лежат в одной плоскости, вторая связь между углеродам образуется перекрыванием негибридных р-орбиталей, оси симметрии р-орбиталей располагаются перпендикулярно плоскости, в которой лежат σ-связи.
Гомологический ряд алкенов.
Для алкенов кроме скелетной изомерии наблюдаются изомерия положения кратной связи и пространственная (цис-, транс- или Е-,Z- изомерия).
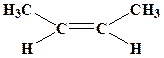

цис-бутен-2 транс-бутен-2
(Z-изомер) (Е-изомер)
Старшинство заместителей определяется по их атомной массе первого атома, связанного с углеродом при двойной связи.
Физические свойства. Первые три члена гомологического ряда – газы, С5-С16 – жидкости, далее – твердые.
МЕТОДЫ ПОЛУЧЕНИЯ
1. Пиролиз и крекинг нефти:
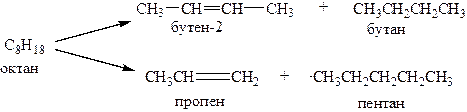
2. Каталитическое дегидрирование алканов (Cr2O3 – катализатор)

3. Из галогенпроизводных углеводородов путём отщепления HHal (где Hal =Cl, Br или I) под действием спиртовых растворов NaOH или KOH при нагревании:
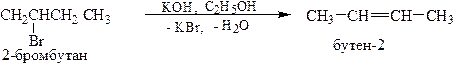
Реакция протекает в соответствии с эмпирическим правилом А.М.Зайцева: отщепление ННal осуществляется от соседних атомов углерода таким образом, что водород отнимается от того из них, при котором водородов меньше (от наименее гидрогенизированного атома углерода).
4. Из вицинальных дигалогенпроизводных алканов (содержащих атомы галогена у соседних атомов углерода) путём отщепления двух атомов галогена с помощью активного металла (Zn, Mg) нагреванием в спиртовой среде:
|
|
|
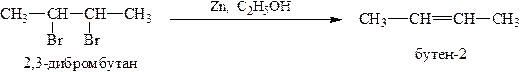
5. Дегидратация спиртов проходит при нагревании в присутствии дегидратирующего агента (H3PO4 , H2SO4 или Al2O3).
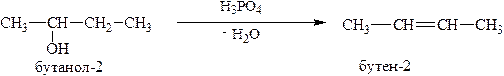
ХИМИЧЕСКИЕ СВОЙСТВА
В природе алкены практически не встречаются, т.к. при нормальных условиях они обладают высокой реакционной способностью и легко вступают в реакции присодинения по электрофильному механизму.
1. Реакции присоединения (AE)
1.1. Каталитическое гидрирование (присоединение водорода на катализаторах – металлах платиновой группы – Ni, Pt, Pd)
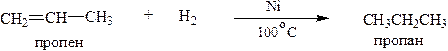
1.2. Галогенирование (присоединение Hal2 , где Hal=Cl, Br, I) обычно проводят в среде органических растворителей из-за плохой растворимости алкенов в воде. Однако даже пробулькивание газообразных низших алкенов через водный раствор брома, окрашенного в жёлтый цвет, происходит его обесцвечивание:
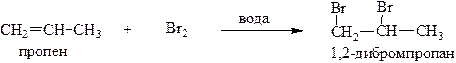
Эта реакция является качественной на обнаружение соединений с кратными связями.
1.3. Гидрогалогенирование (присоединение ННаl, где Hal = Cl, Br, I) проходит в соответствии с правилом В.В.Марковникова: присоединение полярных молекул типа НХ (Х = Hal, OH) к несимметричным алкенам происходит к атомам углерода при двойной связи с разрывом кратной связи, причем водород, преимущественно, присоединяется к более гидрогенизированному атому углерода.


*Исключение из правила Марковникова: присоединение HВr в присутст-вии перекисей (например H2O2 ) происходит против правила Марковникова:
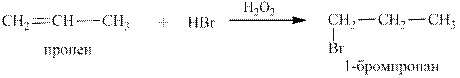
1.4. Гидратация (присоединение воды в присутствии сильной минеральной кислоты) происходит по правилу Марковникова.
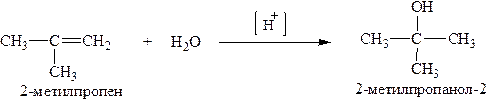
[H+] – условное обозначение кислой среды.
2. Реакции окисления:
2.1. Окисление в «мягких» условиях (неполное окисление, реакция Вагнера)
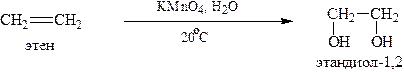
2.2. Окисление в «жёстких» условиях (полное, исчерпывающее окисление) происходит в присутствии сильной кислоты с разрывом углеродной цепи в районе двойной связи и образованием карбоновых кислот из углеводородных остатков:
|
|
|
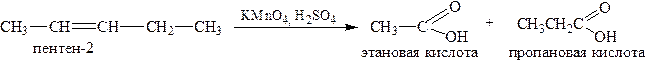 Если у углерода при двойной связи есть разветвление углеродной цепи, то в этом случае образуется кетон вместо карбоновой кислоты:
Если у углерода при двойной связи есть разветвление углеродной цепи, то в этом случае образуется кетон вместо карбоновой кислоты:
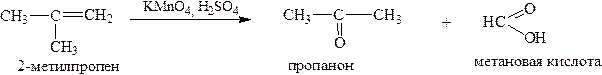
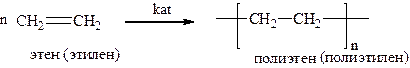
3. Полимеризация – образование полимерной молекулы под действием различных катализаторов. При написании схемы реакции обычно справа указывают элементарное звено полимера в квадратных скобках, тот остаток от мономера, который многократно повторяется в полимерной цепи.
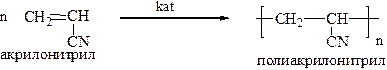
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 365; Нарушение авторских прав?; Мы поможем в написании вашей работы!