
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подставляя выражение скорости реакции, получим
q1 = Q V k Cv e-E/RT (5)
 |
где k — константа скорости реакции; v — порядок реакции; e-E/RT — экспоненциальная функция Аррениуса, выражающая зависимость скорости реакции от температуры.
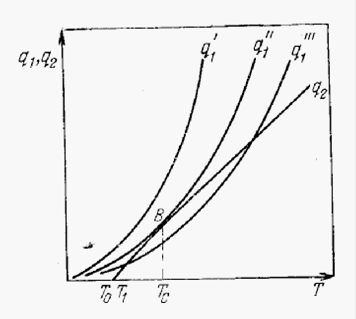
Рис.12. Изменение скорости тепловыделения и теплоотвода при различных концентрациях горючей смеси
Выделившаяся теплота передается горючей смеси, и она нагревается. Как только температура смеси превысит температуру внешней среды, начнется теплоотвод через стенки сосуда в окружающую среду. Количество отводимого тепла q2 в единицу времени в первом приближении можно считать пропорциональным разности температур смеси и окружающей среды
q2 = αS (Т – То) (6)
где α — коэффициент теплоотдачи от газа стенке сосуда, кДж/(м2-с-К); S — поверхность стенок сосуда, м2; Т — температура смеси, К; То — температура стенок сосуда, К.
Если предположить, что коэффициент теплоотдачи а не зависит от температуры, то потери тепла [уравнение ] окажутся линейной функцией температуры. Предположим также, что до начала горения концентрация газа практически не меняется, тогда предыдущее уравнение в системе координат q— Т будет представлять экспоненциальную кривую.
На рис. 12 представлено графическое изображение уравнений (5) и (6) с учетом принятых допущений. Система кривых q1 соответствует различным скоростям химической реакции в зависимости от различных начальных концентраций реагирующего газа. При протекании реакции по кривой q1'" самовоспламенения не произойдет. Вначале вследствие превышения тепловыделения над теплоотводом смесь, начиная с температуры То, будет разогреваться до температуры Т1, после чего наступит устойчивое тепловое равновесие. При этом скорость реакции, достигнув некоторого значения при Т1, начнет непрерывно падать, поскольку уменьшаются концентрации реагирующих веществ. Рассматриваемый случай соответствует процессу медленного окисления. Если реакция протекает по кривой q1, то тепловыделение всегда превышает теплоотвод. В этом случае смесь с самого начала будет непрерывно саморазогреваться, скорость реакции быстро примет высокие значения и в результате этого в системе произойдет самовоспламенение.
Граница между областями неограниченного и ограниченного разогрева реагирующей смеси соответствует протеканию реакции по кривой q1 ". При этом смесь может саморазогреваться до температуры, при которой наступает тепловое равновесие (точка В ). Однако, в отличие от ранее разобранного случая, это равновесие неустойчивое. Даже незначительное повышение температуры То вызовет прогрессирующий саморазогрев системы, приводящий к самовоспламенению.
Таким образом, условием перехода реагирующей системы к самовоспламенению является касание линий тепловыделения и теплоотвода, когда тепловыделение и теплоотвод равны (q1 = q2 ). Температура этого теплового равновесия является температурой самовоспламенения.
Н. Н. Семенов первым показал, что в химических системах, в которых возможна разветвленная цепная реакция, самоускорение реакции, приводящее к самовоспламенению, может произойти при постоянной температуре. Такое самовоспламенение было названо цепным. Условием цепного самовоспламенения является превышение в системах числа разветвляющихся пеней над числом обрывающихся цепей.
Чисто цепное самовоспламенение — довольно редкое явление, так как оно протекает при таких низких давлениях и температурах, при которых немногие горючие вещества самовоспламеняются. Например, цепное самовоспламенение смеси водорода с кислородом при 485 °С происходит в интервале давлений от 773 до 1093 Па.
В процессе неразветвляющейся цепной реакции, как правило, не развивается большая скорость химического превращения, и процесс обычно не завершается самовоспламенением. Тот общеизвестный факт, что фотохимическая реакция хлора с водородом все же оканчивается взрывом (самовоспламенением), объясняется тем, что при достаточно большой скорости денной реакции тепловыделение превышает теплоотвод, в результате чего смесь сильно нагревается, и возникают условия, необходимые для теплового самовоспламенения.
|
|
Дата добавления: 2014-01-07; Просмотров: 392; Нарушение авторских прав?; Мы поможем в написании вашей работы!