
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень диссоциации - a
|
|
|
|
- доля вещества, которая продиссоциировала к моменту равновесия:
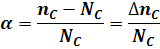
Очевидно, что степень диссоциации является степенью превращения вещества C в реакции диссоциации: a = ХC.
Поэтому можно записать:
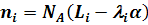 (5)
(5)
Между b, ХА и a существует связь:

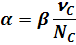

Связь константы равновесия с мерой реакции, степенью превращения и степенью диссоциации в каждом конкретном случае разная и зависит от вида уравнения.
Константу равновесия, выраженную через парциальные давления и концентрации реагентов можно представить в виде:

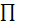 - математический оператор, обозначающий произведение парциальных давлений (концентраций) продуктов реакции деленное на произведение парциальных давлений (концентраций) исходных реагентов:
- математический оператор, обозначающий произведение парциальных давлений (концентраций) продуктов реакции деленное на произведение парциальных давлений (концентраций) исходных реагентов:

Парциальные давления и концентрации равны соответственно:

где p - общее давление,
V - объем.
Отсюда:
 (6)
(6)
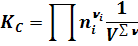 (7)
(7)
Используя уравнение состояния:

имеем:
 (8)
(8)
 (9)
(9)
Число моль каждого вещества можно выразить через меру реакции, степень превращения и степень диссоциации по уравнениям (2), (4) и (5). Таким образом:
K = f(b, p)
K = f(X, p)
K = f(a, p)
K = f(b, V)
K = f(X. V)
Следовательно, при постоянном давлении уравнения позволяют определить степень завершенности реакции (a, b, Х) и установить влияние давления или объема от них.
Имея значения степени завершенности реакции можно определить числа моль всех веществ, т.е. состав равновесной смеси.
Определение состава равновесной смеси по степени завершенности реакции
Рассмотрим в общем виде связь меры реакции и степени завершенности с константой равновесия .
Дана реакция, протекающая в газовой фазе:
aA + bB = cC + dD
Пусть NA, NB, NC, ND NИ - числа моль реагентов и инерта в исходной смеси до реакции.
В соответствии с уравнением (2) числа моль каждого из веществ в равновесной смеси равны:
|
|
|
nA = NA - ab
nB = NB - bb
nC = NC + cb (10)
nD = ND + db
nИ = Nи
Общее число моль всех веществ равно:
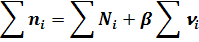
где

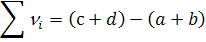
На основе уравнения (6) можно записать:
 (11)
(11)
При постоянной температуре константа равновесия является постоянной величиной и уравнение (11) выражает зависимость меры реакции от давления b = f(p).
Зная Ni, nI и давление можно определить меру реакции b, а следовательно, и число моль всех веществ в равновесной смеси на основе уравнений (10).
Аналогичные уравнения можно получить с использованием степени превращения.
Число моль веществ A, B, C, D и инерта в равновесной смеси можно выразить, используя уравнение (4):
nA = NA(LA - lAX)
nB = NA (LB - lBX)
nC = NA(LC + lCX) (12)
nD = NA(LA + lDX)
nИ = NИ = NALИ
где
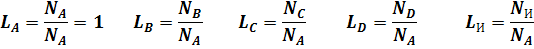

Общее число моль всех веществ в равновесной смеси равно:
 (13)
(13)
где
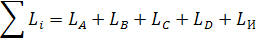


В этом случае уравнение (6) для константы равновесия выглядит следующим образом:
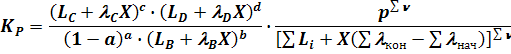 (14)
(14)
где

При постоянной температуре это уравнение (14) представляет собой зависимость степени превращения от давления X = f(p).
Используя уравнение (8) запишем:
 (15)
(15)
Это уравнение (15) дает зависимость степени превращения от объемы X = f(V).
При составлении уравнений для константы равновесия используют следующие приемы.
Рассмотрим пример.
Пусть исходная смесь содержит 60 % водорода, 20 % азота и 20 % инертного газа. В результате реакции образовался аммиак при давлении 50 бар и конечной температуре 673°К. Определить максимальное количество (в %) водорода, превращающегося в аммиак и содержание аммиака (в %) в образованной смеси. КР = 0,0125 (для данных условий).
Уравнение реакции 3/2 H2 + 1/2 N2 = NH3
Имеем:
а = 3/2 b = 1/2 c = 1
ån = с - (a + b) = - 1
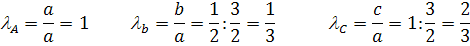
Примем, что в исходной смеси 100 кмоль. Тогда:
NA = 60 NB = 20 NИ = 20 NC = 0
LA = 1 LB = 20/60 = 1/3 LИ = 1/3 LC = 0
Равновесный состав газовой смеси можно выразить, обозначая через х степень превращения одного из исходных реагентов.
Долю водорода превращающегося в NH3 обозначим через х.
|
|
|
Число моль веществ в равновесной смеси на основе уравнения (12):
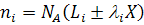
запишется следующим образом:

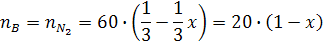


Общее число моль (кмоль) в равновесной смеси в соответствии с уравнением (13) равно:
åni = 60×åLi - 60×x×ålI = 60× 5/3 - 60×x× 2/3 = 100 - 40x
Подставляя соответствующие величины в уравнение (6) или (11), получим:

Это уравнение можно решить методом итераций (последовательных приближений). Разность между двумя сторонами уравнения должна быть равна нулю при правильном значении х. Последовательные подстановки дают следующие значения разности:
х = 0,1 d = 0,399
х = 0,2 d = 0,075
х = 0,218 d = 0,005
х = 0,220 d = -0,006
х = 0,219 d = 0
Отсюда, количество водорода превращающего в аммиак равно 21,9 %.
Количество аммиака в равновесной смеси составит:

При стехиометрическом соотношении исходных веществ, количество одного из них принимают равным определенной величине, например, 1 моль, а равновесную степень превращения его обозначают через Х. Тогда в соответствии с уравнением реакции можно выразить равновесный состав смеси и написать уравнение для константы равновесия через число моль веществ, участвующих в реакции.
Например, для реакции N2 + O2 «2NO
за исходный состав можно принять 1 моль азота и, соответственно, 1 моль кислорода. Если степень превращения азота (или кислорода) Х, то в равновесной газовой смеси будет содержаться:
(1 - Х) моль N2
(1 - Х) моль О2
2Х моль NO
Сумма числа молей:
åni = (1 - X) + (1 - X) + 2X = 2
Так как в результате протекания реакции сумма числа молей компонентов не меняется, т.е. Dn = 2 - 1 - 1 = 0, то

или
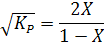
Зная величину константы равновесия, из последнего выражения определяют равновесную степень превращения X, а по ней - равновесный состав газовой смеси.
Выражения, связывающие константу равновесия некоторых наиболее распространенных типов реакций с равновесной степенью превращения, приведены в таблице 1.
Таблица 1. Выражения КР для некоторых типов реакций
| Тип реакции | Вид уравнения для КР | Тип реакции | Вид уравнения для КР |
| А «2В | 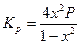
| 2А «3В | 
|
| А «3В | 
| А «В + С | 
|
| 2А «В | 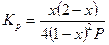
| А «В + 2С | 
|
| А + В «С | 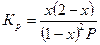
| А + В «С + D | 
|
| 2А + В «С | 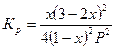
| 2А + В «2С | 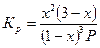
|
| А + В «2С | 
| А + 2В «С + D | 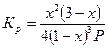
|
| А + В «3С | 
| 2А «В + С | 
|
Определение состава равновесной смеси на основе закона сохранения массы элементов
|
|
|
В этом случае состав равновесной смеси определяется на основе совместного решения системы уравнений, включающей
ü уравнение баланса атомов элементов до и после реакции
ü уравнение для константы равновесия данной реакции
Запишем общую методику составления системы уравнений для определения состава равновесной смеси.
Пусть вещества, участвующие в реакции, В1, В2 …Вi состоят из атомов разного сорта А1, А2 …Aj.
Число химических элементов, как правило, меньше числа веществ на единицу.
Исходная смесь веществ (до реакции): 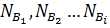
Равновесная смесь веществ (после реакции): 
Количество атомов элемента А1 во всех веществах до реакции:

Количество атомов элемента А1 в равновесной смеси (после реакции):

На основе баланса  =
= запишем:
запишем:
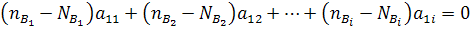

Аналогичные уравнения можно записать для элементов А2, А3 и т.д.
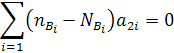
……………. (16)

Число уравнений равно числу элементов Aj, число веществ Bi на единицу меньше.
Уравнением, замыкающим систему, является уравнения для константы равновесия:
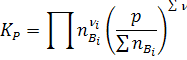 (17)
(17)
Решая совместно систему уравнений (16) и (17) можно определить состав равновесной смеси ( ).
).
Число моль инертного газа nИ необходимо учитывать в сумме общего числа моль åni равновесной смеси в уравнении (17), если åni ¹ 0.
Рассмотрим решение предыдущего примера на основе закона сохранения массы элементов.
Уравнение реакции 3/2 H2 + 1/2 N2 = NH3
Состав исходной смеси:

Состав равновесной смеси:
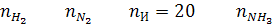
На основе уравнения (16) запишем:
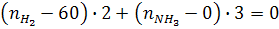 (а)
(а)
 (б)
(б)
По уравнению (21) запишем:
 (в)
(в)
Здесь

Из уравнений (а) и (б) можно выразить 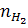 ,
,  и åni, например, через
и åni, например, через 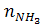 :
:
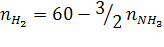
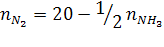

Подставим эти величины в уравнение (в) р = 50 бар:

Отсюда 
Содержание аммиака (%) в равновесной смеси равно:

Результат получается тот же, что и при использовании для расчетов степени превращения Х для водорода.
Замечу, что при определении состава равновесной смеси с помощью меры реакции, степени превращения и степени диссоциации решается одно уравнение. Полученное значение степени завершенности подставляется в уравнение, связывающее меру реакции, степени превращения и степень диссоциации с числом моль отдельных веществ в равновесной смеси.
|
|
|
В методе материального баланса элементов необходимо решить несколько уравнений, число которых равно числу веществ, участвующих в реакции.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 407; Нарушение авторских прав?; Мы поможем в написании вашей работы!