
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста для ЭДС гальванического элемента
|
|
|
|
Электрической характеристикой электрода является электродный потенциал, а гальванического элемента (электрохимической цепи) ‑ электродвижущая сила (ЭДС),
ЭДС правильно разомкнутой электрохимической цепи в отсутствии диффузионного потенциала соответствует разности потенциалов правого (положительного) и левого (отрицательного) электродов и всегда положительна.
ЭДС гальванического элемента
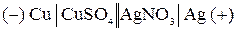
равна:
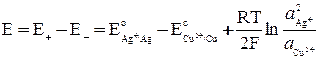
где 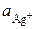 и
и 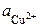 – активности ионов Ag+ и Cu2+ в растворах их солей.
– активности ионов Ag+ и Cu2+ в растворах их солей.
Обозначим
 ,
,
где Е о – стандартная ЭДС гальванического элемента. Тогда
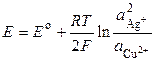 . (3)
. (3)
Уравнение (3) носит название уравнения Нернста для ЭДС гальванического элемента.
Если в гальваническом элементе протекает обратимая химическая реакция
 , то
, то
 , (4)
, (4)
где

Уравнение Нернста в форме (4) применимо для расчета ЭДС любого гальванического элемента (по суммарной химической реакции) и потенциала любого электрода (по электродной реакции). ЭДС связана с термодинамическими характеристиками реакции. Известно, что
 .
.
9.4 Классификация обратимых электродов.
Классификация обратимых электродов основана на свойствах веществ, участвующих в потенциалопределяющих процессах.
1. Электроды первого рода.
Электроды первого рода – это металлические электроды, обратимые относительно катионов (в том числе амальгамные) (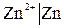 ) и металлоидные, электроды обратимые относительно анионов (
) и металлоидные, электроды обратимые относительно анионов (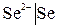 ).
).
Если электрод обратим относительно катиона Zn2+/Zn, то для него можно записать:
 ,
,

Для амальгамного электрода Zn2+/Zn(Hg):
 ,
,
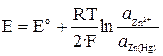 .
.
Если электрод обратим относительно аниона, то
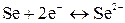 ,
,
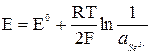 .
.
К электродам первого рода относятся также газовые электроды (водородный  , хлорный
, хлорный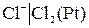 и др.). Они могут быть обратимы по отношению к катиону (H+) или аниону (Cl-). Например, водородный электрод обратим по отношению к катиону. Уравнение электродного процесса для него может быть записано в виде:
и др.). Они могут быть обратимы по отношению к катиону (H+) или аниону (Cl-). Например, водородный электрод обратим по отношению к катиону. Уравнение электродного процесса для него может быть записано в виде:
|
|
|
 .
.
Потенциал водородного электрода определяется выражением
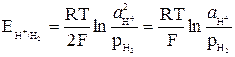 ,
,
и может быть связан с pH раствора.
Для хлорного электрода 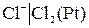 с потенциалопределяющей реакцией
с потенциалопределяющей реакцией
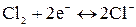 .
.
Металл (Pt) в газовых электродах необходим для создания контакта между газом и раствором, должен быть инертен по отношению к веществам, находящимся в растворе, и способен катализировать только один потенциалопределяющий процесс.
2. Электроды второго рода.
Электродом второго рода называют систему, в которой металл покрыт слоем его труднорастворимого соединения, а в растворе находятся анионы, одноименные с анионами, содержащимися в этом труднорастворимом соединении.
Рассмотрим в качестве примера хлорсеребряный электрод, представляющий собой серебряную пластинку, покрытую слоем хлорида серебра и погруженную в раствор содержащий ионы Cl-:
 .
.
В потенциалопределяющей реакции на этом электроде принимают участие как катионы, так и анионы. Электрохимическому процессу
 (5)
(5)
сопутствует химическая реакция, приводящая к осаждению или растворению AgCl:
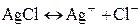 . (6)
. (6)
Суммарное уравнение реакции, согласно которой электрод обратим относительно аниона записывается в виде:
 . (7)
. (7)
Реакции (7) соответствует следующее выражение для расчета электродного потенциала:
 . (8)
. (8)
Хлорсеребряный электрод можно рассматривать и как электрод первого рода, обратимый относительно катиона (реакция 6). У такого электрода активность ионов серебра в растворе определяется растворимостью AgCl. Потенциал электрода равен
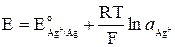 . (9)
. (9)
Для труднорастворимой соли AgCl
 . (10)
. (10)
Подставив выражение (10) в (9), получим:
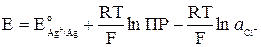 . (11)
. (11)
Выражения (8) и (11) определяют одно и тоже значение 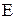 .
.
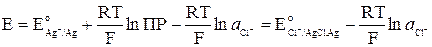
Откуда видно, что связь стандартных потенциалов соответствующих электродов I и II рода определяется уравнением
|
|
|
 .
.
Последнее выражение позволяет определить ПР труднорастворимого соединения по значениям стандартных электродных потенциалов.
Другим примером электрода второго рода является каломельный электрод (рис. 2), состоящий из ртути, покрытой пастой, содержащей каломель Hg2Cl2, и соприкасающейся с раствором KCl:  . Потенциалопределяющая реакция:
. Потенциалопределяющая реакция:
 ;
;
потенциал каломельного электрода определяется выражением
 .
.

Рис. 2. Каломельный электрод.
1 — ртуть, 2 — платиновая проволока, 3 — паста из каломели, 4 — стеклянная трубка, 5 — пробка, 6 — боковая трубка, 7 — сифон, 8 — раствор KCl.
По концентрации применяемого раствора KCl различают 0,1 н., 1 н. и насыщенный каломельные электроды. Последний используется наиболее широко.
Вследствие стабильности своих потенциалов, электроды второго рода используются как электроды сравнения при потенциометрических измерениях.
3. Окислительно-восстановительные электроды.
Все электроды, которым соответствуют потенциалопределяющие реакции с участием электронов, являются окислительно-восстановительными системами. Однако принято в особую группу выделять электроды, в потенциалопределяющих реакциях которых не участвуют простые вещества – газы, металлы. Их называют окислительно-восстановительными (редокс-электроды).
Эти окислительно-восстановительные электроды состоят из инертного вещества с электронной проводимостью (например, платина), погруженного в раствор, содержащего вещества с различной степенью окисления (Red и Ox).
Металл обменивается электронами с участниками окислительно-восстановительной реакции и принимает определенный потенциал при установлении равновесия в системе. Его роль сводится к подводу и отводу электронов к веществам, реагирующим на поверхности электрода.
В общем виде схема электрода и уравнение электродной реакции будут, например, следующими:
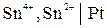 ,
,
 .
.
Потенциал редокс-электрода определяется по уравнению
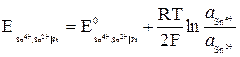 .
.
К окислительно-восстановительным относятся в первую очередь электроды, в которых Ox и Red являются ионами, а электродная реакция состоит в перемене их заряда. Например, системам
 ;
; 
соответствуют следующие потенциалопределяющие реакции:
 ;
; 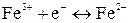 .
.
Кроме рассмотренных, относительно простых редокс-электродов, существует более сложные окислительно-восстановительные электроды, в потенциалопределяющих реакциях которых участвуют ионы Н+ и молекулы воды.
|
|
|
Наиболее используемым из таких электродов на практике является хингидронный электрод, представляющий собой платиновую пластинку, погруженную в исследуемый раствор, в котором содержится небольшое количество хингидрона (ХГ) – эквимолекулярного соединения хинона и гидрохинона С6Н4О2·С6Н4(ОН)2.
В воде это соединение малорастворимо и распадается на хинон С6Н4О2 (Х) и гидрохинон С6Н4(ОН)2 (ГХ). Схема электрода и потенциаопределяющая реакция будут следующими:
 ,
,
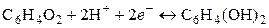 .
.
Потенциал хингидронного электрода равен
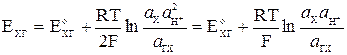 ,
,
где а Х и аГХ – активности хинона и гидрохинона. Так как хинон и гидрохинон малорастворимы, то их активности можно принять равными концентрациям, а поскольку последние равны между собой, то а Х = аГХ. Тогда
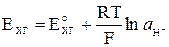 .
.
С учетом того, что  , получаем
, получаем
 ,
,
Т. о. хингидронный электрод может быть использован для определения pH:
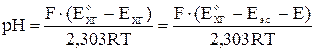 , если
, если 
где E э.с. – потенциал электрода сравнения,
E – ЭДС гальванического элемента, составленного из электрода сравнения и хингидронного электрода.
Хингидронный электрод может быть использован для измерения рН кислых и слабощелочных растворов (до рН = 8), не содержащих окислителей и восстановителей. Достоинством электрода является простота устройства и быстрое установление равновесного потенциала.
Пример 9.2. Определить рН раствора, если при 298 К ЭДС элемента
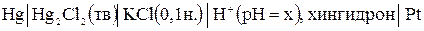 равна 0,15 В. Стандартный потенциал хингидронного электрода при этой температуре равен 0,699 В, потенциал каломельного электрода ‑ 0,337 В.
равна 0,15 В. Стандартный потенциал хингидронного электрода при этой температуре равен 0,699 В, потенциал каломельного электрода ‑ 0,337 В.
Решение.

 В;
В;
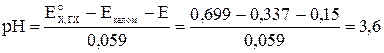 .
.
Для геологии важно, что величина окислительно–восстановительного потенциала в природных водах отражает равновесное окислительно-восстановительное состояние всех находящихся в данной воде систем, содержащих элементы с переменной валентностью. Поэтому величина электродного потенциала служит наиболее общим показателем окислительно-восстановительного режима вод и отражает условия их формирования. Так, восходящие минеральные воды характеризуются обычным восстановительным состоянием, а в зоне выветривания происходят окислительные процессы. На величину редокс–потенциала вод большое влияние оказывает соприкосновение их с кислородом — основным окисляющим фактором земной поверхности. Наиболее восстановленными из природных вод оказались горячие воды Пятигорска, а наиболее окисленными — природные воды, доступные воздействию кислорода воздуха, например, нарзан из каптажного колодца в Кисловодске.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6383; Нарушение авторских прав?; Мы поможем в написании вашей работы!