
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчинні форми, розчинення, константа дисоціації
|
|
|
|
Аналогічні полімерні сполуки із гідратизованих іонів через мостики OH можуть формувати інші Al3+, Be2+, Bi3+, Ce4+, Cu2+, Ga3+, Mo5+, Pb2+, Sc2+, Sn4+, Si4+, U4+. Додатковий H+ може втрачатися із димеру, спричинюючи подальшу полімеризацію аж до формування колоїдних частинок і формування осаду, наприклад Fe(OH)3, Si(OH)4 чи Al(OH)3.
При взаємодії із водою відбувається дисоціація мінералів, перш за все із іонним типом зв‘язку (галіт, флюорит, кальцит, барит і інші). Знання процесів розчинення мінералів надзвичайно важливе для встановлення поведінки мінералів в гідротермальних умовах і в процесах вивітрювання та при формуванні складу підземних вод.
Тут потрібно згадати, що таке константа рівноваги. У випадку розчинення ми її будемо називати константа дисоціації. Якщо ми знаємо константу рівноваги, ми можемо розрахувати концентрацію іонів в розчині.
Наприклад, нам потрібно оцінити концентрацію Ca2+ в ґрунтовій воді (при 25° C) в рівновазі із флюоритом, якщо концентрація F- в розчині складає 1·10-4 М.
Дисоціація флюориту відбувається за реакцією
CaF2 = Ca2+ + 2F-
Константа дисоціації
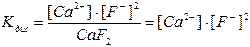 |
Активність CaF2 приймаємо рівним 1. Значення Kдис складає 3,9·10-11, тоді
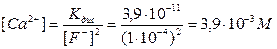
Баланс маси і комплексоутворення

Таблиця 6.2. Поширені форми знаходження хімічних елементів у природних водних розчинах


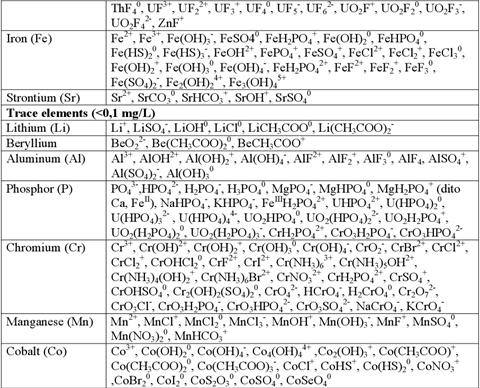



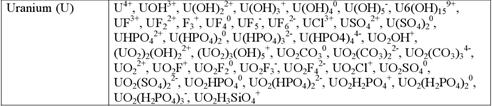
Константи рівноваги іонних реакцій (константи дисоціації) в широкому інтервалі температур і тисків можуть бути розраховані, ґрунтуючись на термодинамічних константах (DG, S, H, cp) мінералів та компонентів розчину. На жаль термодинамічні характеристика багатьох іонів та нейтральних сполук в водних розчинах відсутні, що зумовлено складністю їх експериментального визначення при підвищених температурах і тисках. Хоча із кожним роком бази термодинамічних даних для розчинних сполук поповнюються.
|
|
|
Для багатьох геологічно важливих реакцій, особливо при температурах нижче 350°С такі дані існують, табульовані в багатьох роботах (Борисов, Шваров,1992; Карпов и др, 1977; Shock E.L., Helgeson H.C., 1987, Walther, 2005). Розрахувавши зміну вільної енергії Ґібса при дисоціації мінералу можна вирахувати константу дисоціації і оцінити концентрацію окремих іонів в розчині.
В розчині присутні прості іони (Na+, K+, Ca2+), комплексні іони (CaCl-, FeCl-), нейтральні молекули (CH40, NaCl0, CaCl20).
Більшість металів присутня у водних розчинах у вигляді комплексних сполук (табл. 6.2).
Метали і ліганди, що формують комплекси, діляться на сильні проміжні та слабкі (табл. 6.3). Найбільш важливі ліганди: Cl-, OH-, HS-, H2O, NH3, F-, Sx2-, HCO3-, органічні кислоти. Сильні метали асоціюють із сильними лігандами; слабкі метали - із слабкими лігандами. Проміжні метали можуть, в залежності від температури та концентрації аніонів не утворювати комплексів, або ж утворювати їх із сильними або слабкими лігандами. Сильні ліганди і метали витісняють слабкі із комплексів. Одночасно комплекс одного металу може містити як сильні так і слабкі ліганди, наприклад Cu+ утворює Cu(H2O)5Cl o.
Таблиця 6.3. Класифікація лігандів і металів
| Метали | Сильні | Проміжні | Слабкі |
| H+, Li+, Na+, K+, Ca2+, Mg2+,Ba2+,Sn4+, Mo3+,W4+,Fe3+,Al3+ | Fe2+, Ni2+, Cu2+, Zn2+, Pb2+, Sn2+, Bi3+ | Cu+, Ag+, Au+, Cd+, Hg+, Hg2+, Meo | |
| Лiганди | NH3, H20, OH-, CO32-, PO43-, SO42-, F-, Cl- | Br- | CN-, CO, H2S, HS-, J- |
| Вiдносна сила поширених iонiв в комплексах | |||
| F- > Cl- > Br- | |||
| Cu2+ > Ag+ > Au+ | |||
| H+ > Li+ > Na+ > K+ | |||
| Zn2+ > Cd2+ > Hg2+ | |||
| Zn2+ > Pb2+ |
Ліганди конкурують із водою за координаційні центри. Для формування мінералу необхідно зруйнувати оболонку лігандів чи молекул води навколо металу, що потребує
великої енергії. Оболонка лігандів може зруйнуватись внаслідок зміни складу розчину, що викликає відтягнення лігандів на формування сполук із нижчою вільною енергією.
|
|
|
CuCl2- + Ca2+ = CaCl20 + Cu+
При формуванні комплексу відбувається реакція гідратизованого катіону із лігандом. Для прикладу, так виглядає формування ціанідного комплексу Fe2+

Важливою складовою низькотемпературних водних розчинів є органічні комплекси – амінокислотні (NH2RCOO), карбоксилатні (ацетатні, оксалатні, цитратні та інші).

Стійка до деградації рослинна органіка в ґрунті дає гумідні і фульватні кислоти, що розчиняються в лужних розчинах і можуть бути активними комплексоутворювачами, зокрема для важких токсичних металів.
| 
|
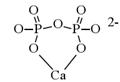
| Рис. 6.6. Пірофосфатний хелат кальцію (зліва) і нітроацетатний хелат двохвалентного металу (справа) |
Активними комплексоутворювачами є синтетичні сполуки, що попадають в довкілля із відходами виробництва – етилендіамін-тетраацетат (EDTA), нітроацетат (NTA, N(CH2CO2)3).
Звичайно ліганд утворює із металом один зв’язок. Деякі складні органічні та пірофосфатні (P2O74-) ліганди формують два або більше зв’язків із катіоном. Такі комплекси називаються халатними. Вони дуже стійкі і мають здатність легко потрапляти в харчові ланцюги, а тому важливі як форми перенесення токсичних металів.
халатні комплекси.
Одновалентні катіони Na+ і K+ звичайно не входять в склад комплексів, тоді як катіони із більшою валентністю переважно знаходяться у вигляді комплексів.
Зростання розчинності металів внаслідок комплексоутворення можна проілюструвати на прикладі алюмінію. Він присутній в розчині у вигляді іону Al3+ і різноманітних неорганічних (табл.. 6.2) і органічних комплексів. Розчинність алюмінію контролюється осадженням гібситу Al(OH)3 за реакцією
Al3+ + 3H2O = Al(OH)3 gibbsite + 3H+, where Ks = a 3H+/ a Al3+ (6.1)
де активності води і мінералу приймаються рівними 1.
Розчинність алюмінію визначається максимальним значенням активності Al3+ що відповідає співвідношенню a 3H+/ a Al3+ ~ Ks. Збільшення активності Al3+ призводить до осадження гібситу.
Із врахуванням гідроксикомплексу Al(OH)4-
Al3+ + 4H2O = Al(OH)4- + 4H+, where Kc = a Al(OH)4(-) a 4H(+)/ a Al(3+)
Із збільшенням активності Al3+ реакція зміщується в сторону зростання активності Al(OH)4-, тобто реальна концентрація Al в слабо лужних розчинах перевищує рівноважну, розраховану за рівнянням (6.1).
|
|
|
Багато важких токсичних металів присутні в ґрунті у вигляді слабо розчинних, при відсутності комплексоутворювачів, сполук і можуть бути у значних концентраціях у вигляді різноманітних комплексів. Тому, оцінка форми знаходження металу, зокрема співвідношення різних комплексів є важлива при оцінці переміщення токсичних металів в геохімічних системах довкілля.
| Таблиця 6.4. Основні іони і комплекси в морській воді | Таблиця 6.5. Сполуки цинку у морській воді |

|  
|
Для розрахунків потрібні дані стосовно констант комплексоутворення. Покажемо це на прикладі комплексів цинку
n Zn2+ + Cl‑ = ZnCl+ K1 =21 (pK1 =-1,3)
n ZnCl+ + Cl- = ZnCl20 K2 =7,9 (pK2 =-0,9)
Розрахунок залежності типу комплексу в 0.001 M розчині Zn від концентрації Cl-
| Записуємо рівняння балансу масс і константи рвноваг | 
|
| Розв’язок здійснюється графічно. Із рівнянь констант рівноваги записуємо pK1 = p[ZnCl+] - p[Zn2+] - p[CI-] pK2 = p[ZnCl20] - p[Zn2+] - 2p[Cl-] і pK2-pK1 = p[ZnCl20] - p[ZnCl+] - p[Cl-] 2. Зайдемо точки p[Cl-], де будуть рівності p[ZnCl-] = p[Zn2+] = -log(Ct/2) p[ZnCl20] = p[ZnCl+] = -log(Ct/2) Отримуємо залежність концентрації іонів та комплексів від концентрації Cl-. | 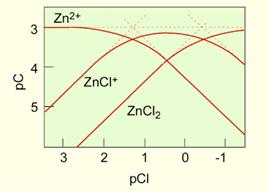 Рис. 6.7.
Рис. 6.7.
|
Аналогічним чином розраховані концентрації комплексів цинку в рівновазі з сфалеритом в гідротермальних умовах (Walther, 2005) (рис. 6.8).

Рис. 6.8. Розчинність сфалериту при нейтральному pH як функція активності Cl- в розчині при 350°С і 1 кбар із log fO2 =-30,22 і log fS2= -9,38.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2707; Нарушение авторских прав?; Мы поможем в написании вашей работы!