
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферування і титрування
|
|
|
|
N Буферна система опирається зміні pH при додаванні кислоти чи основи
N Буферна система виникає у випадку, якщо кислота і, зв’язана з нею, основа знаходяться в однакових концентраціях
Буферна система pH
Розглянемо наступний випадок. Якщо до 1000 г чистої води додати 10-3 моля HCl, pH зміниться із 7 до 3.
Візьмемо розчин 0,01 моля Na2CO3 (карбонат натрію) і 0,01 моля NaHCO3 (гідрокарбонат натрію) в 1000 г H2O. Обидві солі повністю дисоціюють і розчин містить 0,03 m Na++, 0,01 m CO32-, 0,01 m HCO3-. pH цього розчину встановлюється рівновагою CO32-↔ HCO3- і рівне 10,3(рис. 3). Додамо до розчину 10-3 моля HCl. Це приведе до зміщення реакції
H+ + CO32- = HCO3-
вправо. Концентрація HCO3- складе 0,011 m, а CO32- – 0,009 m.
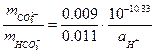
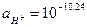 pH=10,24. Ми бачимо, що зміни pH незначні, порівняно із такою ж процедурою для чистої води.
pH=10,24. Ми бачимо, що зміни pH незначні, порівняно із такою ж процедурою для чистої води.
В морській воді pH працює додатковий буфер
CaCO3 + H+ = Ca2+ + HCO3- (pK=8,43)
В морській воді, що знаходиться в постійному контакті із CO2 атмосфери, рівновага в системі CO32- - HCO3- - CaCO3 утримує pH в інтервалі 8,0 – 8,35.
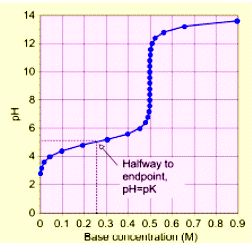
| 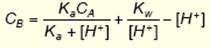 нахил лінії титрування визначає буферну ємність розчину
нахил лінії титрування визначає буферну ємність розчину
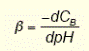
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 473; Нарушение авторских прав?; Мы поможем в написании вашей работы!