
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Мономолекулярные реакции в газовой фазе
Реакции в растворах
Мономолекулярные и тримолекулярные реакции.
От температуры
Зависимость скорости фотохимических реакций
Скорость фотохимической реакции не зависит от температуры, если конечные продукты реакции образуются непосредственно из возбужденных частиц, если лимитирующей стадией образования конечных продуктов является фотохимический процесс, или энергия активации «темновых» реакций (то есть обычных) очень мала. Энергия электронного возбуждения молекул обычно имеет более высокое значение, чем прирост средней тепловой энергии при нагревании от комнатной до повышенных температур. Например, повышение температуры ацетальдегида от 20 до 220оС приводит к увеличению средней тепловой энергии на 12,5 кДж/моль, в то время как энергия электронного возбуждения молекулы ацетальдегида составляет около 418,4 кДж/моль. Поэтому направление и эффективность фотолиза мало зависят от температуры. Зависимость скорости первичного фотохимического процесса от температуры может быть значительной, если энергии поглощенного кванта не хватает для разрыва связи.
Лекция 39
В настоящее время известно большое число гомогенных газовых реакций, удовлетворяющих кинетическим уравнениям первого порядка. Мономолекулярный распад претерпевают, как правило, сложные молекулы, состоящие из большого числа атомов; энергии активации большинства реакций относительно высоки.
При низких давлениях для большинства мономолекулярных реакций наблюдается интересное явление перехода реакции в реакцию второго порядка.
Иногда при низких давлениях наблюдается резкий рост константы скорости реакции. Это объясняется появлением при низких давлениях значительного количества свободных радикалов. Например, при распаде ацетальдегида получаются радикалы ·СН3 и ·СНО:
СН3СНО ® ·СН3 + ·СНО,
способные вступать во взаимодействие с исходным веществом по цепному механизму. Цепной процесс может быть подавлен добавкой газов, взаимодействующих с радикалами. Особенно характерно действие NO, молекула которого обладает одним неспаренным электроном. При столкновении со свободным радикалом NO легко к нему присоединяется, обрывая цепь, и значение константы скорости становится соответствующим истинному мономолекулярному распаду.
В 1922 г. Линдеман дал схему, позволяющую понять механизм мономолекулярных реакций, исходя из представлений о столкновении молекул. Для того чтобы произошел мономолекулярный процесс распада молекулы А, ей необходимо обладать достаточной колебательной энергией для разрыва связей. Эту энергию молекула может накопить путем соударений, то есть процесс активации молекулы можно записать в виде
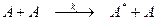 ,
,
где А * – возбужденная молекула.
Наряду с процессом активации в результате столкновений происходит и дезактивация
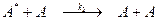 .
.
Оба эти процесса поддерживают равновесную концентрацию активных молекул [ A *], соответствующую распределению Максвелла – Больцмана. В отсутствие химической реакции доля активных молекул не зависит от давления (концентрации), а число их прямо пропорционально давлению (концентрации), поскольку с изменением давления пропорционально изменяются и скорость активации, и скорость дезактивации. При наличии химической реакции убыль концентрации активных частиц происходит и в результате процесса их распада:
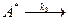 продукты реакции.
продукты реакции.
При установившемся процессе постоянство концентрации активных молекул определяется условием
скорость активации = скорость дезактивации + скорость реакции, то есть
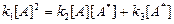 , (1)
, (1)
откуда
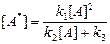 , (2)
, (2)
а скорость реакции
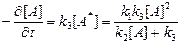 . (3)
. (3)
Активные молекулы А * имеют определенное время жизни tА*, связанное с вероятностью превращения А * в конечные продукты. В зависимости от соотношения tА* и времени между столкновениями tст уравнение (3) может быть представлено в двух предельных формах.
При высоких давлениях столкновения настолько часты (tст << tА*), что почти все молекулы А * дезактивируются, не успевая прореагировать, то есть k 2[A] << k 3, и
 (4)
(4)
Таким образом, реакция является процессом первого порядка.
С понижением давления время между столкновениями возрастает и может превысить время жизни активной молекулы (tст >> tА*). Тогда большая часть молекул, не успевая дезактивироваться, претерпевает превращение, то есть k 3 >> k 2[A] и
 ,
, (5)
(5)
что соответствует процессу второго порядка.
Таким образом, схема Линдемана позволяет объяснить как механизм активации, так и причины перехода мономолекулярных реакций при низких давлениях в реакции второго порядка.
Если исходить из схемы Линдемана, то между мономолекулярными и бимолекулярными реакциями нет принципиальной разницы. В зависимости от условий (температуры, давления) и свойств реагирующей системы (времени жизни активного состояния) любой процесс, активируемый двойными столкновениями, может идти как по первому, так и по второму порядку.
Гиншельвуд первым обратил внимание на необходимость учета внутренних степеней свободы молекулы, претерпевающей мономолекулярный распад. В его теории и еще более отчетливо во всех последующих теориях учитываются колебательные составляющие внутренней энергии молекулы
Теория Гиншельвуда основана на двух положениях:
1. Молекула становится способной к мономолекулярному распаду только в том случае, если на всех колебательных степенях свободы молекулы сосредоточится некоторая критическая энергия e а .
2. Достижение суммарной энергии e а является необходимым и достаточным условием для активации. Различия в реакционной способности молекул, обладающих любым избытком энергии по сравнению с e а вплоть до ¥, не рассматриваются.
Можно показать, что число активных молекул, даваемое теорией Гиншельвуда, равно
 , (6)
, (6)
где s – число колебательных степеней свободы.
Все активированные молекулы (по Гиншельвуду) обезличены, поэтому константа скорости реакции 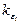 , независимо от значения e i, равна некоторой постоянной величине l.
, независимо от значения e i, равна некоторой постоянной величине l.
Скорость реакции при больших давлениях равна
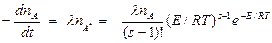 . (7)
. (7)
Уравнение (7) отличается от выражения, даваемого теорией столкновений, на множитель (E/RT)s-1 / (s-1)!.
Теория Гиншельвуда дает хорошее согласие с опытными значениями скоростей реакции для ограниченного набора колебательных степеней свободы, но полный учет колебательных степеней свободы приводит к неправдоподобно большому теоретическому значению скорости. Объясняется это тем, что, вероятно, не все степени свободы принимают участие в активации молекулы, ибо разрыв обычно происходит по небольшому числу связей – чаще всего одной.
Дальнейшее развитие теории мономолекулярных реакций шло по линии уточнения понятия активированной молекулы. Очевидно, молекула, обладающая энергией, равной или большей e а, не всегда способна к мономолекулярному превращению. Активны только те молекулы, у которых избыток энергии концентрируется на определенных связях.
|
|
Дата добавления: 2014-01-07; Просмотров: 1829; Нарушение авторских прав?; Мы поможем в написании вашей работы!