
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы изучения кинетики сложных реакций
|
|
|
|
Как уже говорилось ранее (см. лекцию 32), большинство химических реакций относится к последовательным реакциям с промежуточными стадиями, однако в подавляющем числе случаев детальный механизм реакции нам неизвестен из-за трудностей выявления промежуточных продуктов.
Точное математическое решение задачи о двух последовательных реакциях первого порядка ведет к формулам, малоудобным для практического использования. Так, полученные уравнения для концентраций конечного (у) и промежуточного (х – у) продуктов нельзя решить относительно констант
y = a (1 – 
 +
+ 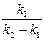
 ),
),
x – y = а 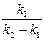 (
( –
–  ).
).
Следовательно, константы уже невозможно вычислять непосредственно из опытных данных по зависимости концентрация – время, их приходится подбирать. Можно себе представить, в какой степени возрастет громоздкость уравнений в более сложных случаях, например, при нескольких последовательных и параллельных реакциях различных порядков, а именно такую совокупность процессов представляют собой механизмы многих обычных реакций, таких, как образование бромоводорода или воды. Точное математическое решение задачи часто оказывается вообще невозможным, и тогда при изучении кинетики прибегают к приближенному методу стационарных концентраций (методу Боденштейна).
Приведем обоснование этого метода. Для этого рассмотрим реакцию
А + В ® 2С. (1)
Предположим, что она протекает с образованием двух весьма неустойчивых промежуточных продуктов М1 и М2 :
1) А ® 2М1 k 1
2) М1 + В ® С + М2 k 2 (2)
3) М2 + А ® С + М1 k 3
4) М1 + М1 ® А k 4.
Первая из этих элементарных реакций мономолекулярна, остальные – бимолекулярны. Запишем сначала скорости изменения концентраций устойчивых веществ
 (3)
(3)
|
|
|
а затем для промежуточных продуктов М1 и М2 :
 (4)
(4)
Из стехиометрических соотношений (1) и (2) можно рассчитать также числа прореагировавших молей (объем реагирующей системы при этом считается постоянным):
 (5)
(5)
Концентрации неустойчивых продуктов [M1] и [M2] в течение всей реакции очень малы по сравнению с концентрациями исходных веществ и устойчивых продуктов. В связи с этим стехиометрические соотношения (5) можно упростить:
[A]0 – [A] = [C]/2 и [B]0 – [B] = [C]/2. (6)
Дифференцируя (6) по времени, получаем выражения
 и
и  , (7)
, (7)
показывающие отсутствие заметного отставания скорости накопления продуктов от скорости убыли исходных веществ.
В уравнение (7) можно подставить выражение для скоростей из соотношений (3). Получим


или
2 k 1 [A] – k 2 [M1] [B] + k 3 [M2] [A] – 2 k 4 [M1]2 = 0.
Согласно (4), последнее выражение равно 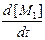 . Следовательно,
. Следовательно,
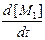 = 0. (8)
= 0. (8)
Аналогично, используя второе из уравнений (7), получим
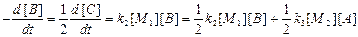
или
k 2 [M1] [B] – k 3 [M2] [A] = 0,
то есть, согласно (4),
 = 0. (9)
= 0. (9)
Таким образом, вследствие образования неустойчивых промежуточных продуктов в очень малых концентрациях получаются важные условия стационарности (8) и (9).
Практическое значение метода Боденштейна очень велико. Он позволяет, приравнивая нулю общие скорости образования или разложения неустойчивых промежуточных продуктов, выразить их концентрации через концентрации легко анализируемых веществ и затем подставить в уравнение скорости изучаемой реакции. Последнее сопоставляют с эмпирическим уравнением скорости и судят таким образом о пригодности предполагаемого механизма реакции. Рассмотрим использование метода стационарных концентраций на некоторых примерах.
Большой интерес представляет реакция образования бромоводорода, изученная Боденштейном и Линдом (1906 г.):
H2 + Br2 ® 2HBr
Изучение проводилось в интервале температур 230-300°С. Как выяснилось, в отличие от внешне похожей реакции образования иодоводорода в данном случае кинетическое уравнение имеет сложный вид (об этом уже говорилось ранее):
|
|
|
 (10)
(10)
В 1919-1920-х гг. Христиансен, Герцфельд и Поланьи предложили механизм, объясняющий сложный характер этого уравнения. Данный механизм предусматривает образование в качестве промежуточных продуктов свободных атомов брома и водорода:
(а) Br2  Br + Br
Br + Br
(б) Br + H2  HBr + H
HBr + H
(в) H + Br2 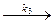 HBr + Br
HBr + Br
(г) H + HBr  H2 + Br
H2 + Br
(д) Br + Br  Br2
Br2
Из приведенной схемы вытекает, что скорость образования HВr может быть выражена следующим уравнением
 (11)
(11)
Применим принцип стационарности к концентрациям свободных атомов водорода и брома:

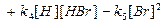 (12)
(12)
 (13)
(13)
Складывая уравнение (12) с уравнением (13), найдем
2 k 1 [Br2] – k 2 [Br] [H2] + k 3 [H] [Br2] + k 4 [H] [HBr] – k 5 [Br]2 +
+ k 2 [Br] [H2] – k 3 [H] [Br2] – k 4 [H] [HBr] = 0
Отсюда 2 k 1 [Br2] = k 5 [Br]2, или
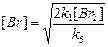 . (14)
. (14)
Подставим (14) в (13):
 ,
,
или
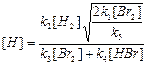 . (15)
. (15)
Подставляя концентрации атомов брома и водорода из уравнений (14) и (15) в уравнение (11), получим окончательное уравнение, определяющее скорость образования HBr:
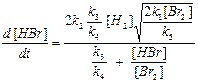 ,
,
от которого легко перейти к уравнению (10). Видно, что скорость реакции в начале процесса, когда [Br2] >> [HBr], оказывается прямо пропорциональной  , то есть квадратному корню из скорости процесса (а), в результате которого образуются атомы брома, инициирующие весь процесс.
, то есть квадратному корню из скорости процесса (а), в результате которого образуются атомы брома, инициирующие весь процесс.
Можно вообще отметить, что появление в кинетическом уравнении концентрации в степени ½ обычно свидетельствует об участии в механизме реакции свободных атомов или радикалов, гибнущих преимущественно в результате рекомбинации при столкновении друг с другом (реакция (д) в последнем примере).
Метод стационарных концентраций можно также с успехом применить для объяснения кинетического уравнения реакции окисления иодид-ионов ионами Fe3+ в водном растворе (при небольших степенях превращения):
 .
.
Предположим, что механизм процесса следующий:
Fe3+ + 2J–  Fe2+ + J2–, Fe3+ + J2–
Fe2+ + J2–, Fe3+ + J2–  Fe2+ + J2.
Fe2+ + J2.

Здесь можно считать концентрацию промежуточного вещества J2– стационарной.
Скорость образования J2 равна
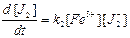 .
. 
Очевидно, если выразить концентрацию вещества J2–, являющегося неустойчивым промежуточным продуктом, через концентрации обычных, относительно устойчивых (а значит, и легко аналитически определяемых) веществ и подставить это соотношение в приведенное уравнение, то получится определенное кинетическое уравнение, которое можно будет сопоставить с экспериментально найденным уравнением.
|
|
|
 ,
,
отсюда
 ,
,
следовательно,
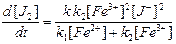 .
.
При небольших степенях превращения можно пренебречь в знаменателе величиной k 1 [Fe2+]:
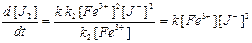 ,
,
что соответствует эксперименту.
Лекция 41
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1282; Нарушение авторских прав?; Мы поможем в написании вашей работы!