
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Каталитических процессов
|
|
|
|
Основные характерные черты гетерогенных
Теория промежуточных соединений
Гетерогенный катализ.
Для объяснения действия гетерогенного катализатора Д.И.Менделеев предложил теорию промежуточных соединений (1886). Он высказал ряд интересных мыслей о природе гетерогенного катализа. Он указал, что свойства молекул на поверхности раздела фаз в энергетическом отношении отличаются от свойств молекул в объеме; процесс удерживания молекул на поверхности связан с выделением тепла, которое может идти на активирование молекул; молекулы на поверхности переходят в более реакционноспособное состояние, поэтому для химических процессов большое значение имеет контакт молекул на границе раздела фаз; реакции на границе раздела фаз идут с большими скоростями при невысоких температурах.
Идея образования промежуточных соединений развивалась далее Сабатье и рядом других исследователей, особенно школой Н.Д.Зелинского. Согласно этой идее, катализатор образует с одним из реагентов промежуточное соединение, активируя данный реагент и облегчая реакцию. Типичными промежуточными соединениями являются сорбционные соединения
Pt – H, Ni – H, Pd – H и др.
Отсюда следует и один из основных принципов гетерогенного катализа: катализатор обладает физическим или химическим сродством к одному или нескольким реагентам. Например, гидрогенизационные и дегидрогенизационные катализаторы Pt, Pd, Ni, Cu и другие легко сорбируют водород, образуя с ним промежуточные соединения (палладий даже способен растворять газообразный водород). Гидратирующие и дегидратирующие катализаторы, например Al2O3 или Al2(SO4)3, обладают способностью образовывать гидратного типа соединения с водой; их действие в реакции дегидратации спиртов, таким образом, подобно действию серной кислоты.
|
|
|
Аналогичные явления имеют место и на окислительных катализаторах: платина и палладий легко образуют с кислородом сорбционные поверхностные соединения; оксид меди (CuO) легко восстанавливается до металлической меди и снова окисляется до CuO. Ванадий образует ряд оксидов разных степеней окисления, легко переходящих друг в друга.
Таким образом, важно не только одно сродство катализатора к реагирующему веществу, но и лабильность, неустойчивость получающегося промежуточного соединения, легко вновь распадающегося при взаимодействии со вторым реагирующим компонентом на продукты реакции и вновь готовый к действию катализатор. Интересным примером подобной регенерации катализатора является получение водяного газа на Fe3O4, которое может быть изображено следующим стехиометрическим уравнением:

Первой стадией этого процесса является восстановление Fe3O4 оксидом углерода:
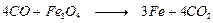
Затем железо, взаимодействуя с водой, дает водород и регенерируется в Fe3O4:

Оба эти процесса и дают в сумме приведенное выше стехиометрическое уравнение.
Практически важным свойством гетерогенного катализатора, как и всякого катализатора, является специфичность его действия. Различные катализаторы могут направлять процесс по совершенно разным путям. Так, из этанола могут быть получены семь различных продуктов в зависимости от выбора катализатора или условий его применения:
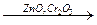 CН2=СНСН=СН2 + Н2 + 2Н2О CН2=СНСН=СН2 + Н2 + 2Н2О
| |
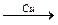 СН3СНО + Н2 СН3СНО + Н2
| |
| С2Н5ОН | 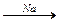 С4Н9ОН + Н2О С4Н9ОН + Н2О
|
 СН3СООС2Н5 + 2Н2 СН3СООС2Н5 + 2Н2  СН3СОСН3 + 3Н2 + СО СН3СОСН3 + 3Н2 + СО
| |
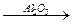 (С2Н5)2О + Н2О (С2Н5)2О + Н2О 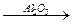 С2Н4 + Н2О С2Н4 + Н2О
|
Специфичность действия катализатора, позволяющая вести процесс в желательном направлении, является одним из основных свойств, используемых при практическом применении катализатора в промышленности. Избирательное каталитическое действие по теории промежуточных продуктов связано с образованием промежуточных соединений разной химической природы на разных катализаторах.
|
|
|
Уже давно установлено, что присутствие в реагирующей смеси некоторых веществ, часто в совершенно ничтожном количестве, способно понижать или полностью подавлять активность катализатора. Такие вещества получили название каталитических ядов, а само явление назвали отравлением катализаторов. Типичными каталитическими ядами являются соединения серы (H2S, CS2, тиофен, меркаптаны и др.), синильная кислота, оксид углерода, свободные галогены (I2, Cl2, Br2), ртуть и соли ртути [HgCl2, Hg(CN)2 ], соединения фосфора, мышьяка, свинца и другие. Отравление катализатора происходит вследствие сорбции яда на поверхности катализатора, в результате чего затрудняется доступ к ней реагирующих веществ. Поскольку сорбция может быть обратимой и необратимой, различают обратимое и необратимое отравление. Например, платиновый катализатор отравляется в присутствии CO и CS2, однако при внесении его в чистую исходную смесь газов активность катализатора быстро восстанавливается. При отравлениях же H2S и РН3 платина необратимо и полностью дезактивируется.
Иногда действие яда удается использовать для направления процесса в желательном направлении (благоприятствующее отравление). Так, гидрирование бензоилхлорида в бензольном растворе над платиной приводит через ряд последовательных стадий к образованию толуола


Между тем отравление платины небольшим количеством соединений серы (например, путем подмешивания их к исходной смеси или употребления в качестве растворителя неочищенного бензола) позволяет с хорошими выходами остановить реакцию на стадии получения ценного продукта – бензальдегида.
Прибавление к катализатору вещества, которое само по себе является каталитически недеятельным, вызывает иногда весьма значительное повышение эффективности процесса. Такие вещества получили название промоторов. Как правило, эффективность действия промотора зависит от его количества: наблюдаются максимумы активности при определенном составе смешанного катализатора. Явление промотирования находит большое применение на практике, позволяя повышать активность, срок действия и избирательность катализатора.
|
|
|
Массивный металлический катализатор работает только своей поверхностью, которая составляет, по количеству действующего каталитически вещества, ничтожную долю всей массы катализатора. Поэтому уже давно стали употреблять нанесенные катализаторы, приготовляемые нанесением тонкого слоя активного вещества на каталитически недеятельный носитель. В качестве носителей чаще всего используют вещества с высокоразвитой поверхностью: уголь, силикагель, алюмогель, асбест, пемзу, кизельгур, стекло, фарфор и др. Носитель применяют не только для экономии катализатора (что имеет немаловажное значение для таких катализаторов, как Ir, Pt, Pd, Au, Ag, Os); он способен в небольших пределах изменять активность катализатора, проявляя определенный промотирующий эффект. Кроме того, устойчивость нанесенных катализаторов по отношению к температурному воздействию и к отравлению ядами, как правило, резко повышается в сравнении с массивными металлическими катализаторами.
Нужно отметить, что для большинства (но не для всех) катализаторов предварительное прогревание, необходимое для их активирования, может привести, начиная с некоторой, характерной для каждого катализатора температуры, к понижению, а при дальнейшем увеличении температуры прогревания – и к полной потере активности. Происходит, как говорят, «спекание» катализатора. Носитель препятствует спеканию, повышая срок и температурный интервал действия катализатора. Благодаря этому оказывается возможным во многих случаях повышать температуру проведения процесса, ускоряя его и повышая выход продукта реакции.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 643; Нарушение авторских прав?; Мы поможем в написании вашей работы!