
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ион-ионное взаимодействие в растворах электролитов
Для любой обратимой реакции электролитической диссоциации
Кn+ Аn- Û n+ Кz+ + n– Az–
сумма n+ + n– равна общему числу n ионов, образующихся при диссоциации одной молекулы; связь с изотоническим коэффициентом Вант-Гоффа дается уравнением
 i = 1 + (n+ + n– - 1)×a = 1 + (n - 1)×a,
i = 1 + (n+ + n– - 1)×a = 1 + (n - 1)×a,
где a – степень электролитической диссоциации. По теории электролитической диссоциации Аррениуса
a =  =
= 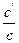 ,
,
то есть представляет собой отношение числа продиссоциировавших молекул N¢ к общему числу молекул N; a зависит от концентрации электролита и температуры.
Кд,с = 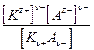 ,
,
где Кд,с - константа диссоциации, выраженная через концентрации, или так называемая классическая константа диссоциации. Для бинарного электролита, в соответствии с законом разведения Оствальда,
Кд,с = 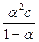 .
.
Кд,с является константой только для разбавленных растворов слабых электролитов. Если a << 1 (Кд,с < 10-5 ), то ее величиной можно пренебречь, и формула примет вид
Кд,с = a2с; a =  .
.
Зависимость Кд,с от температуры описывается уравнением
 ,
,
где DНдис – теплота диссоциации. Работу диссоциации Адис определяют по уравнению изотермы Вант-Гоффа
Адис = – DGо = RT ln Kc.
Для концентрированных растворов слабых электролитов и для растворов сильных электролитов любой концентрации в термодинамические уравнения следует подставлять активности. Для растворов электролитов мы имеем две величины, характеризующие активность растворенной соли. Первая из них - это мольная активность, то есть активность соли, определяемая независимо от диссоциации; она находится теми же экспериментальными методами и по тем же формулам, что и активность компонентов в неэлектролитах (по давлению пара, температуре затвердевания, по данным о растворимости, методом ЭДС). Вторая величина - средняя ионная активность а ±. Так как нет методов экспериментального определения значений а+ и а – в отдельности, то вводят среднюю ионную активность а ±, определяемую соотношением
а ±n = а.
Концентрация и активность связаны между собой через коэффициенты активности
a + = g+¢ m +, a – = g–¢ m –, a ± = g±¢ m ±,
где g+¢ и g–¢ – коэффициенты активности ионов; m ± – средняя ионная моляльность и g±¢ – средний ионный коэффициент активности:
g±¢ = (g¢+n+×g¢-n-)1/n, m ± = (m +n+× m -n-)1/n = (n+n+×n-n-)1/n m.
Основные величины связаны соотношениями
a ± = g±¢ m ± = g±¢ (n+n+×n-n-)1/n m = L g±¢ m,
где L = (n+n+×n-n-)1/n и для солей каждого определенного типа валентности является величиной постоянной; значения L для солей различного валентного типа приведены в табл. 7.
Таблица 7
Значение постоянной L для различных электролитов
| Валентный тип электролита | Электролит | L |
| 1 – 1 2 – 2 3 – 3 | KCl ZnSO4 La[Fe(CN)6] |
(11 × 11)1/2 =  = 1 = 1
|
| 2 – 1, 1 – 2 | CaCl2 , Na2SO4 | (11 × 22)1/3 = (22 × 11)1/3 =  = 1,587 = 1,587
|
| 3 – 1, 1 – 3 | AlCl3 , K3[Fe(CN)6] | (11 × 33)1/4 = (33 × 11)1/4 = 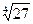 = 2,280 = 2,280
|
| 3 – 2 | Al2 (SO4)3 | (22 × 33)1/5 =  = 2,551 = 2,551
|
Так как нет экспериментальных методов определения коэффициентов активности отдельного сорта ионов g+¢ и g–¢, активность отдельных ионов в растворе можно приближенно оценить из соотношений
a + = g±¢ m +, a – = g±¢ m –,
причем для сильных электролитов (полностью продиссоциировавших)
m + = n+ m, m – = n– m.
В растворах-электролитах, как и в растворах-неэлектролитах, могут быть использованы следующие активности и коэффициенты активности:
g± =  - рациональный коэффициент активности (практически не применяется);
- рациональный коэффициент активности (практически не применяется);
g±¢ =  - практический коэффициент активности (средний моляльный);
- практический коэффициент активности (средний моляльный);
f ± =  - средний мольный коэффициент активности.
- средний мольный коэффициент активности.
Средние коэффициенты активности в различных шкалах концентраций связаны следующими соотношениями:
f ± = g±¢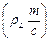 ; g± = g±¢ (1 + 0,001nML m);
; g± = g±¢ (1 + 0,001nML m);
g± = f ± [r – 0,001 с (M – ML)]×(1/rL),
где rL и ML – плотность и молекулярная масса чистого растворителя соответственно, M – молекулярная масса растворенного вещества, r – плотность раствора.
Основными методами измерения величин коэффициентов активности являются криоскопический и метод ЭДС.
Льюис и Рендалл открыли эмпирический закон ионной силы: средний ионный коэффициент активности g±¢ диссоциирующего на ионы вещества является универсальной функцией ионной силы раствора, то есть в растворе с данной ионной силой все диссоциирующие на ионы вещества имеют коэффициенты активности, не зависящие от природы и концентрации данного вещества, но зависящие от числа и валентности его ионов:
lg g±¢ = - А  .
.
Здесь I – ионная сила раствора, определяемая выражением
I =  ,
,
где i - индексы ионов всех солей в растворе; mi = n i m. Величина А (тангенс угла наклона прямой в координатах lg g±¢ -  ) зависит от температуры, природы растворителя и заряда иона, но не зависит от природы иона. Это означает, что в достаточно разбавленных растворах (I £ 0,1) коэффициенты активности отдельных ионов одинакового заряда приблизительно одинаковы (см. табл. 8).
) зависит от температуры, природы растворителя и заряда иона, но не зависит от природы иона. Это означает, что в достаточно разбавленных растворах (I £ 0,1) коэффициенты активности отдельных ионов одинакового заряда приблизительно одинаковы (см. табл. 8).
Таблица 8
Коэффициенты активности ионов (опытные величины)
| Ионы | Коэффициенты активности ионов при ионной силе растворов I | |||||
| 0,001 | 0,005 | 0,01 | 0,02 | 0,05 | 0,10 | |
| Однозарядные | 0,98 | 0,95 | 0,92 | 0,89 | 0,85 | 0,80 |
| Двухзарядные | 0,77 | 0,65 | 0,58 | 0,50 | 0,40 | 0,30 |
| Трехзарядные | 0,73 | 0,55 | 0,47 | 0,37 | 0,28 | 0,21 |
Коэффициенты активности отдельных ионов, как и среднеионные коэффициенты активности, можно рассчитать теоретически, пользуясь теорией сильных электролитов Дебая и Гюккеля:
– при I £ 0,01 можно воспользоваться первым приближением теории (так называемым предельным законом Дебая и Гюккеля), уравнение (1):
ln g i = – NA 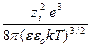
 ,
,
где I – ионная сила раствора, определяемая соотношением I = 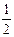 å сi zi 2; k – постоянная Больцмана; zi – заряд иона; е – заряд электрона; e и eо – диэлектрическая проницаемость среды и вакуума соответственно. После перехода к десятичному логарифму и подстановки численных значений постоянных величин
å сi zi 2; k – постоянная Больцмана; zi – заряд иона; е – заряд электрона; e и eо – диэлектрическая проницаемость среды и вакуума соответственно. После перехода к десятичному логарифму и подстановки численных значений постоянных величин
lg g i = – 1,8246×106 (eT)– 3/2 zi 2 .
.
Для данного растворителя и определенной температуры можно написать
lg g i = – zi 2 h  .
.
Для среднего ионного коэффициента активности, который в отличие от коэффициента активности отдельного вида ионов определяется экспериментально, справедливо уравнение
lg g± = – ï z+× z –ï h  . (1)
. (1)
Для водных растворов при 25оС, допуская равенство диэлектрических проницаемостей раствора и растворителя (78,54), h = 0,51. Для 1-1 зарядных электролитов
lg g± = – h 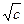 = – 0,51
= – 0,51 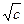 .
.
Предельный закон Дебая – Гюккеля дает верные значения коэффициентов активности 1-1 зарядного электролита, особенно в очень разбавленных растворах (с £ 0,01 моль/л). Сходимость теории с опытом ухудшается по мере увеличения концентрации электролита, увеличения зарядов ионов и уменьшения диэлектрической проницаемости растворителя, то есть с ростом сил взаимодействия ионов.
– во втором приближении средний коэффициент активности описывается уравнением
lg g± = - 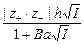 , (2)
, (2)
где h сохраняет прежнее значение; а условно названо средним эффективным диаметром ионов, имеет размерность длины, фактически - эмпирическая постоянная; В = c / . Для водных растворов произведение В а близко к 1. Формула (2) хорошо описывает поведение многих электролитов вплоть до I = 0,1.
. Для водных растворов произведение В а близко к 1. Формула (2) хорошо описывает поведение многих электролитов вплоть до I = 0,1.
– третье приближение теории (уравнение Гюккеля) выглядит следующим образом:
lg g± = - 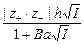 + C I, (3)
+ C I, (3)
где С - эмпирическая константа, лишенная определенного физического смысла. При удачном подборе значений a и С формула Гюккеля хорошо согласуется с опытом и широко используется при расчетах (можно описать экспериментальные данные по g± до I порядка 1-2).
По модели Дебая и Гюккеля, энергия взаимодействия иона с ионной атмосферой, равная энергии заряжения, определяется выражением
U i = – 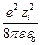 c,
c,
где c = 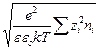 =
=  .
.
Величина 1/c отождествляется с радиусом ионной атмосферы.
|
|
Дата добавления: 2014-01-07; Просмотров: 2274; Нарушение авторских прав?; Мы поможем в написании вашей работы!