
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественная характеристика реакций кислот с основаниями
|
|
|
|
Первой стадией всех рассмотренных выше реакций, протекающих при кислотно-основном и электрофильном катализе, является взаимодействие апротонной Е или протонной АН кислоты с основанием В по одной из равновесных реакций:
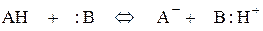
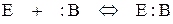 ,
,
где АН и В могут быть как катализаторами, так и реагентами. Эффективность катализа в значительной степени определяется положением этих равновесий и концентрацией реагента, активированного катализатором.
В соответствии с концепцией жестких и мягких кислот и оснований, предложенной Пирсоном, кислоты и основания классифицируют по способности взаимодействовать друг с другом. Согласно этой концепции все кислоты и основания подразделяют на жесткие и мягкие, в зависимости от положения энергетического уровня граничных орбиталей: высших заполненных (ВЗО) в основаниях и низших вакантных (НВО) в кислотах.
Жесткие кислоты. Атом акцептора пары электронов основания имеет НВО с низкой энергией, как правило, положительно заряжен, имеет небольшой размер и не обладает легко возбудимыми внешними электронами. К жестким кислотам относятся катионы элементов, мало способные к поляризации (Н+, Li+, Na+, K+, Mg2+, Cu2+, Fe3+, Th4+, Ti4+), соединения бора и алюминия (BF3, A1C13, A1R3).
Жесткие основания. Атом донора электронов имеет ВЗО с низкой энергией, низкую поляризуемость, высокую электроотрицательность и трудно окисляется. К жестким относятся преимущественно основания, имеющие свободную пару электронов на атомах О, N и F (F , НО
, НО , C2H5O
, C2H5O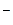 , NO
, NO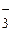 , РО
, РО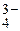 , NH
, NH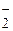 , NH3, R3N).
, NH3, R3N).
Мягкие кислоты. Атом акцептора электронов имеет НВО с высокой энергией, малый положительный заряд, большой размер и легко возбудимые внешние электроны. К мягким кислотам относятся легко поляризующиеся катионы металлов (Сu+, Hg2+, Pd2+, Pt2+, Cd2+) и органические соединения, способные принимать пару электронов на разрыхляющую π-орбиталь, например тетрацианоэтилен.
|
|
|
Мягкие основания. Атом донора электронов имеет ВЗО с высокой энергией, обладает большой поляризуемостью, низкой электроотрицательностью и легко окисляется. К мягким основаниям относятся анионы (HS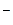 , I
, I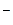 , Br
, Br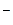 , CH3COS
, CH3COS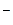 , R
, R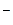 , S2O
, S2O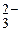 , SCN
, SCN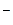 ), нейтральные молекулы (R2S, H2S, PR3, P(OR)3, CO) и молекулы, в которых электроны π-связей взаимодействуют со свободной орбиталью кислоты (олефины, ароматические соединения и т. п.).
), нейтральные молекулы (R2S, H2S, PR3, P(OR)3, CO) и молекулы, в которых электроны π-связей взаимодействуют со свободной орбиталью кислоты (олефины, ароматические соединения и т. п.).
Известно, что эффективное взаимодействие между орбиталями при образовании связи осуществляется в том случае, когда они имеют равные или близкие энергетические уровни. По этой причине жесткие кислоты предпочтительнее взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими основаниями.
Количественную оценку «мягкости» и «жесткости» кислоты или основания можно получить путем определения констант равновесия реакций, в которых происходит:
1) конкуренция за взаимодействие с основанием В между жесткой кислотой (например, Н+) и какой-либо мягкой кислотой (например, CH3Hg+):
СH3Hg+(сольв.) + ВН+(сольв.) Û СН3HgB(сольв.) + Н+(сольв.)
2) конкуренция за взаимодействие с кислотой (М+) между жестким (НО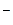 ) и мягким (Сl
) и мягким (Сl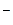 ) основанием:
) основанием:
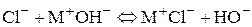
По значениям констант равновесия получаются следующие ряды уменьшения относительной «мягкости» оснований В:
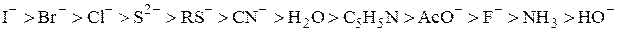
и относительной «мягкости» кислот М+:
Hg2+ > Ag+ > CH3Hg+ > Cd2+ > Zn2+> Ni2+ > Fe2+ > Cu2+ > Cr3+ > Zr4+> H+
Приведенные ряды «мягкости» и «жесткости» кислот и оснований не являются абсолютной количественной мерой их способности взаимодействовать друг с другом, поскольку размер шкалы и даже относительное расположение отдельных кислот и оснований в ряду зависит от выбранных эталонных пар кислот или оснований, от растворителя и других условий. Тем не менее, развитая Пирсоном концепция и имеющиеся количественные данные по равновесиям позволяют обоснованно выбирать электрофильные катализаторы и оценивать их относительную способность активировать реагент в реакциях, подверженных электрофильному и кислотному катализу. Из приведенных данных следует, что, в частности, в реакциях замещения галоген-ионов (мягких оснований) эффективными катализаторами являются мягкие кислоты (например, Ag+), которые образуют с исходными соединениями более прочные комплексы и сильнее активируют реагент. Напротив, для активирования жестких кислородсодержащих оснований более эффективны жесткие кислоты (Н+, Cu2+, Mg2+).
|
|
|
В практике органического синтеза наибольшее распространение имеет катализ протонными кислотами. По теории кислот и оснований, развитой Бренстедом, кислотой (в отличие от изложенной выше классификации Пирсона) называют не протон, который в свободном виде в растворе не существует, а продукт его присоединения к какому-либо основанию (HCl, Н3О+, Н2О и т. д.). Для количественной оценки способности протона связываться с тем или иным основанием пользуются константами равновесия протолитических реакций. При этом в качестве стандартного основания или кислоты используют растворитель – LН (например, Н2О или ROH):
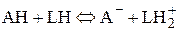
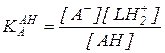 (5.38)
(5.38)
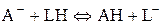
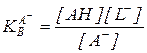 (5.39)
(5.39)
Как видно из приведенных выражений, константа кислотности 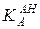 и константа основности сопряженного основания
и константа основности сопряженного основания 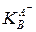 связаны друг с другом через константу автопротолиза растворителя KLH:
связаны друг с другом через константу автопротолиза растворителя KLH:
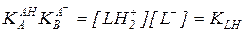 (5.40)
(5.40)
Вместо самих констант кислотности и основности пользуются также их отрицательными логарифмами: рКА = – lgКА и рКВ = – lgКВ, значения которых определены для большого числа веществ в водных растворах и других растворителях и приведены в справочных пособиях.
Пользуясь данными о константах кислотности и основности, измеренными в каком-либо растворителе, можно вычислить константы равновесия всевозможных протолитических реакций взаимодействия различных веществ в этом же растворителе, например:
AH + B
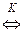 A
A + BH
+ BH
 (5.41)
(5.41)
Таким образом, константа равновесия равна соотношению констант кислотностей или основностей кислот и оснований, участвующих в превращении. В пределах рядов структурно-подобных кислот или оснований относительные значения кислотности или основности при замене растворителя, как правило, сохраняются. Это дает основание пользоваться выражением (5.41) и значениями КА или КВ, полученными в одном растворителе, для расчета констант протолитических равновесий с участием структурноподобных АН и ВН в других растворителях, для которых не измерены абсолютные значения кислотности.
|
|
|
Для кислот и оснований, принадлежащих к разным классам, такие оценки констант протолитического равновесия вдругих растворителях могут привести к ошибочным результатам.
Для создания абсолютной шкалы кислотности, позволяющей независимо от растворителя и концентрации кислоты количественно оценивать протонирующую способность ее раствора, Гаммет предложил использовать индикаторный метод. Представим равновесие протонирования индикатора В уравнением:
 ВН+ В + Н+
ВН+ В + Н+
где Н+- все источники протона в данном растворе. Константа кислотности ВН+ в общем виде равна:
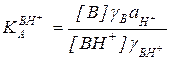 (5.42)
(5.42)
Входящие вуравнение коэффициенты активности свободной и протонированной форм основания γВ и 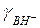 и активность протона
и активность протона 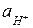 не могут быть измерены непосредственно, однако их комбинация γВ ×
не могут быть измерены непосредственно, однако их комбинация γВ ×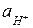 /
/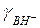 легко находится экспериментально при известном значении
легко находится экспериментально при известном значении 
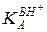 спектрофотометрическим определением соотношения [B]/[BH+]. Этот комплекс величин был назван Гамметом кислотностью:
спектрофотометрическим определением соотношения [B]/[BH+]. Этот комплекс величин был назван Гамметом кислотностью:
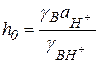 (5.43)
(5.43)
Следовательно, имея набор структурно-подобных индикаторов, в качестве которых Гаммет использовал замещенные нитроанилины, можно определить кислотность среды в широком диапазоне ее изменения по формуле
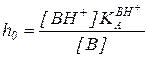 (5.44)
(5.44)
Из уравнения (5.43) следует, что в бесконечно разбавленном водном растворе, когда γi = 1 и 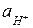 = [H3O+], кислотность равна концентрации ионов гидроксония, чему соответствует шкала рН. В более общем случае кислотность среды численно равна концентрации в ней ионов гидроксония, которые обладают такими же протонирующими свойствами, как в бесконечно разбавленном водном растворе. Отрицательный логарифм кислотности называют функцией кислотности Гамета
= [H3O+], кислотность равна концентрации ионов гидроксония, чему соответствует шкала рН. В более общем случае кислотность среды численно равна концентрации в ней ионов гидроксония, которые обладают такими же протонирующими свойствами, как в бесконечно разбавленном водном растворе. Отрицательный логарифм кислотности называют функцией кислотности Гамета
H0= -lg h0.
На рис. 5.2 приведены данные о H0 для водных растворов кислот, которые показывают, насколько сильно зависит кислотность концентрированных растворов от природы кислоты. Функции кислотности позволяют также сравнивать кислотность растворов в различных растворителях. В качестве примера можно привести кислотность 0,1н. раствора серной кислоты вводе, уксусной кислоте и нитрометане, которая равна соответственно 0,1, 40 и 4000.
|
|
|

|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 708; Нарушение авторских прав?; Мы поможем в написании вашей работы!