
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрический ток в электролитах. Законы электролиза Фарадея
|
|
|
|
Электрический ток в различных средах.
Электролиты относятся к так называемым проводникам второго рода. В отличие от металлов и полупроводников (проводников первого рода), протекание тока в которых не сопровождается какими-либо химическими превращениями, в электролитах протекание тока всегда сопровождается химическими превращениями. Электролитами являются растворы солей, кислот и щелочей в воде и некоторых других жидкостях, а также расплавы солей, являющихся в твердом состоянии ионными кристаллами.
Носителями тока в электролитах являются положительные и отрицательные ионы, на которые диссоциируют (расщепляются) молекулы растворенного вещества. Степень диссоциации характеризуется коэффициентом диссоциации α, показывающим, какая доля молекул растворенного вещества находится в диссоциированном состоянии. Коэффициент диссоциации зависит от химической природы растворителя и концентрации растворяемого вещества. В частности, чем ниже концентрация растворяемого вещества, тем выше коэффициент диссоциации.
Если в электролит ввести твердые проводящие электроды и подать на них напряжение, то ионы придут в движение - возникнет электрический ток (рис.7.1). Положительные ионы (катионы) движутся к отрицательному электроду (катоду); отрицательные ионы (анионы) – к положительному электроду (аноду).

Рис.7.1. Электрический ток в электролите.
Достигнув соответствующих электродов, анионы и катионы отдают избыточные или получают недостающие электроны и превращаются в нейтральные молекулы. Таким образом, прохождение электрического тока через электролит сопровождается выделением на электродах составных частей электролита. Это явление называется электролизом. Основные законы электролиза были установлены в 1836г. Майклом Фарадеем (Faraday M., 1791-1867):
|
|
|
Первый закон Фарадея. Количество вещества, выделившегося на каждом из электродов при электролизе, пропорционально заряду, протекшему через электролит:
 ,
,
где К - электрохимический эквивалент, зависящий от природы вещества.
Второй закон Фарадея. Электрохимический эквивалент всех веществ пропорционален их химическому эквиваленту:

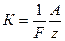
где 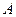 - атомный вес,
- атомный вес, 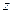 - валентность химического элемента;
- валентность химического элемента; 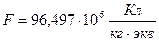 -число Фарадея.
-число Фарадея.
Выделение вещества на электродах начинается лишь с некоторого напряжения, называемого пороговым напряжением разложения электролита Up. Начиная с этого напряжения, в электролите появляется ток, плотность которого подчиняется закону Ома:
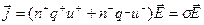
где n+ и n- - концентрация положительных и отрицательных ионов, соответственно; q+ и q- - заряды ионов; u+ и u- - подвижности ионов; σ – электропроводность электролита.
Подвижность ионов зависит от их природы и свойств растворителя. С повышением температуры подвижность ионов возрастает. В электролитах подвижность ионов очень мала. Так, для водных растворов при комнатной температуре она составляет 10-8-10-7  (для сравнения, подвижность электронов в металлах ~10-4
(для сравнения, подвижность электронов в металлах ~10-4 ).
).
Если молекула диссоциирует только на пару ионов, то 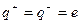 и
и  . В этом случае
. В этом случае
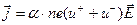
На рис.7.2 представлена ВАХ электролита: 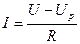 , R – сопротивление слоя электролита между электродами.
, R – сопротивление слоя электролита между электродами.

Рис.7.2. Вольтамперная характеристика электролита.
Электролиз находит самые разнообразные технические применения: гальванопластика и гальваностегия; электрометаллургия; электрополировка металлов; получение тяжелой воды и другие.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4376; Нарушение авторских прав?; Мы поможем в написании вашей работы!