
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения. Алканы – простейший класс органических соединений, не содержащих функциональной группы, отвечают общей формуле – СnН2n+2
|
|
|
|
АЛКАНЫ
УГЛЕВОДОРОДЫ
Алканы – простейший класс органических соединений, не содержащих функциональной группы, отвечают общей формуле – СnН2n+2. Для неразветвленных (нормальных) алканов она может быть представлена:
Н–(СН2)n–H
Номенклатура алканов. Для названия алканов используют следую-щие номенклатуры:
· тривиальную;
· рациональную;
· систематическую.
Тривиальная. Первые четыре представителя с неразветвленной цепью имеют тривиальные названия:
· метан (корень «мет» обозначает группировку, содержащую один атом углерода (от гр. methy –вино, hile – лес);
· этан, содержащий группировку из двух атомов углерода (от гр. aither – небесная субстанция, улетающая к небесам) дух эфира, летучий газ);
· пропан – трехатомная группировка (от гр. protos – первый, pion – жир);
· бутан – черырехатомная группировка (от лат. butyron – масло).
Названия последующих членов ряда, начиная с пентана, образуются от греческих числительных, с указанием числа атомов углерода в цепи, и окончания " ан ".
Рациональная. Предельные углеводороды рассматривают как производ-ные метана, перед названием прототипа перечисляют радикалы (табл. 8) в порядке увеличения числа углеродных атомов.
Систематическая (заместительная, международная, ИЮПАК). По заместительной номенклатуре предельные углеводороды рассматриваются как производные линейных углеводородов, у которых один или несколько атомов водорода замещены на алкильные радикалы.
Изомерия. Для алканов характерны следующие виды изомерии:
Структурная:
· скелетная.
Пространственная:
· конформационная;
· оптическая.
Промышленные методы:
1. Получение из нефти. Алканы С1 – С40 является основной составляющей нефти, где наряду с предельными углеводородами содержатся циклоалканы, ароматические углеводороды, сернистые соединения и другие компоненты. В зависимости от числа атомов углерода алканы, содержащиеся в нефти, подразделяются на следующие группы:
|
|
|
· газообразные алканы состава С1 – С4 содержатся в газовой фракции нефти;
· жидкие алканы от С5 до С10 входят в состав бензиновых фракций, выделены в чистом виде все 5 изомеров гексана, 7 из 9 изомерных гептанов, 16 из 18 изомеров октана и 24 из 35 теоретически возможных изомеров нонана;
· углеводороды состава С11 – С20 содержатся в средних фракциях нефти (180–350 оС), причем содержание нормальных алканов снижается с увеличением молекулярной массы;
· твердые алканы С16 и выше находятся в высококипящих фракциях (350 – 500 оС), их называют в зависимости от состава и температуры плавления парафинами (в основном алканы с Тпл= 45–65 оС) и церезинами (разветвленные алканы).
2. Природный газ. Природный газ состоит на 75% из СН4, 15% СН3–СН3, 5% СН3–СН2–СН3, остальное составляют высшие алканы и другие соединения. Природный газ используют как топливо и сырье для химической промышленности.
3. Гидрогенизация угля. (400–500 оС, 30 МПа, Ф. Бергиус, 1925 г.). катализатор – оксиды и сульфиды молибдена, никеля, кобальта:
С+Н2  СН4
СН4
4. Метод Фишера – Тропша. Каталитическое гидрирование СО и СО2 обычно дает метан. В качестве катализатора используют никель (П. Сабатье, И. Сандеран, 1902 г.):
СO+3Н2  СН4+H2O
СН4+H2O
СO2+4Н2  СН4+2H2O
СН4+2H2O
Процесс каталитического гидрирования СО протекает в зависимости от применяемого катализатора и температуры. В основном образуются низкомолекулярные неразветвленные алканы (Ф. Фишер, Х. Тропш 1913 – 1926 г.):
СO+3Н2  СН4+H2O
СН4+H2O
Метод был усовершенствован: изменен катализатор, давление и температура реакции (Ф. Фишер, Х. Пихлер 1936 – 1941 г.). В настоящее время методом Фишера – Тропша могут быть получены моторные топлива и отдельные углеводороды (алканы, циклоалканы, арены). В основе реакции лежит сорбция СО поверхностью катализатора в результате чего образуются карбонилы кобальта. Водород присоединяется к сорбированному оксиду углерода, образуя карбены и метильные радикалы. Карбен может внедрятся по связи Со–СН3, что приводит к росту углеродной цепи:
|
|
|

В качестве побочных продуктов могут образовываться кислородсодержащие соединения (спирты, альдегиды).
5. Воздействие анаэробных бактерий на растительные остатки:
(С6Н10О5)n + H2O  3n СO2 + 3n СН4
3n СO2 + 3n СН4
Лабораторные методы:
6. Реакция металлорганических соединений с водой. Соединения, содержащие связь металл – углерод, в большинстве случаев легко реагируют с водой, образуя углеводороды.
6.1 Гидролиз карбидов:
Al4C3+12 H2O 3 СН4 + 4 Al(OH)3
3 СН4 + 4 Al(OH)3
CaC2, SrC2 и BaC2 в реакции с водой образуют ацетилен, а Fe3C и Ni3C в реакции с кислотами образуют смеси углеводородов.
6.2 Гидролиз алкилмагнийгалогенидов (реактивов Гриньяра):
R–MgHal + H2O R–H + Mg(OH)Hal
R–H + Mg(OH)Hal
R–Hal + 
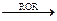 Rδ––δ++MgHal–
Rδ––δ++MgHal–  R–H + Mg(OH)Hal
R–H + Mg(OH)Hal
7. Гидрирование ненасыщенных углеводородов. Реакция происходит при обычных температурах и давлении на катализаторе, в качестве которого используют металлы с недостроенным d -подуровнем, чаще всего это металлы VIII группы.
7.1 Гидрирование алкенов:
R–CH=CH–R + Н2 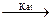 R–CH2–CH2–R
R–CH2–CH2–R
7.2 Гидрирование алкадиенов:
R–CH=CH–CH2–CH=CH–R + 2Н2 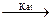 R–CH2–CH2–CH2–CH2–CH2–R
R–CH2–CH2–CH2–CH2–CH2–R
7.3 Гидрирование алкинов:
R–C≡C–R + 2Н2 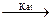 R–CH2–CH2–R
R–CH2–CH2–R
8. Восстановление галогенпроизводных алканов. Восстановление проводят амальгамой натрия, гидридами металлов, водородом на палладии, а также йодистым водородом:
R–Hal + H2 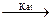 R–H + HHal
R–H + HHal
R–I + HI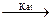 R–H + I2
R–H + I2
9. Реакция Вюрца (Ш. Вюрц, 1855 г.):
2R–Hal + 2Na R–R + 2NaHal
R–R + 2NaHal
3R–Hal + 3R1–Hal + 6Na 2R–R + 2R1–R1 + 2R–R1 + 6NaHal
2R–R + 2R1–R1 + 2R–R1 + 6NaHal
Механизм реакции осуществляется с образованием ион-радикалов и алкильных радикалов:
2Rδ+–Halδ– + 2
 2[R
2[R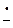 Hal]•–Na+
Hal]•–Na+ 2R• +2Hal– + 2Na+
2R• +2Hal– + 2Na+ R–R + 2NaHal
R–R + 2NaHal
R• +
 RNa
RNa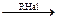 R–R + 2NaHal
R–R + 2NaHal
10. Реакция Вюрца – Гриньяра, катализатор – соли кобальта:
R–Hal + R1–MgHal R–R1 + MgHal2
R–R1 + MgHal2
11. Реакция Кори – Хауса:
R–I + 2Li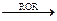 R–Li +LiI
R–Li +LiI
2 R–Li +CuI  R2CuLi + LiI
R2CuLi + LiI
R1–I + R2CuLi 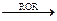 2R1– R + CuI + LiI
2R1– R + CuI + LiI
12. Электролиз солей карбоновых кислот (реакция Кольбе, 1849 г.):
|
|
|
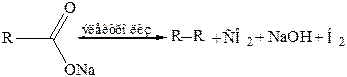
13. Декарбоксилирование солей карбоновых кислот (синтез Дюма):

14. Сплавление гидразонов альдегидов и кетонов со щелочью (реакция Киннера):
R–CH=N–NH2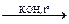 R–CH– H2 + N2
R–CH– H2 + N2
15. Восстановление карбонильных соединений (метод Клемменсена):
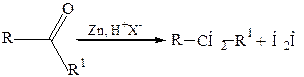
Физические свойства. Алканы представляют собой бесцветные вещества, в обычных условиях газообразные или жидкие, алканы с большим числом углеродных атомов являются твердыми веществами.
Газообразные и твердые алканы не имеют запаха, жидкие имеют характерный бензино-керосиновый запах.
Таблица 19 – Физические свойства алканов
| Соединение | 
| Формула | Температура, °С | Плотность, 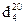
| |
| плавления | кипения | ||||
| метан | СН4 | –182,5 | –161,5 | 0,415* | |
| этан | СН3-СН3 | –183,3 | –88,6 | 0,546* | |
| пропан | СН3СН2СН3 | –187,7 | –42,1 | 0,501* | |
| бутан | СН3(СН2)2СН3 | –138,3 | –0,5 | 0,579* | |
| изобутан | СН3СН(СН3)СН3 | –159,6 | –11,7 | 0,557* | |
| пентан | СН3(СН2)3СН3 | –129,7 | 36,1 | 0,626 | |
| изопентан | СН3СН(СН3)СН2СН3 | –159,9 | 27,9 | 0,620 | |
| гексан | СН3(СН2)4СН3 | –95,3 | 68,7 | 0,660 | |
| гептан | СН3(СН2)5СН3 | –90,6 | 96,4 | 0,684 | |
| октан | СН3(СН2)6СН3 | –56,8 | 125,1 | 0,702 | |
| изооктан | СН3С(СН3)2СН2СН(СН3)2 | –107,4 | 99,2 | 0,692 | |
| нонан | СН3(СН2)7СН3 | –53,5 | 150,8 | 0,718 | |
| декан | СН3(СН2)8СН3 | –29,7 | 174,1 | 0,730 | |
| пентадекан | СН3(СН2)13СН3 | 9,9 | 270,6 | 0,768 | |
| эйкозан | СН3(СН2)18СН3 | 36,8 | 342,7 | 0,789** | |
| триконтан | СН3(СН2)28СН3 | 65,8 | 446,4 | 0,810** | |
| гектан | СН3(СН2)98 СН3 | 115,2 | – | – | |
| полиэтилен (ПЭВД) | 30 – 800 тыс. | –(СН2)n– | – | – | 0,918-0,930 |
| полиэтилен (ПЭНД) | 30 – 800 тыс. | –(СН2)n– | – | – | 0,955-0,968 |
* – При температуре кипения. **Для переохлажденной жидкости.
Связи С–С и С–Н в молекулах алканов практически неполярны, и, следовательно, единственными силами, участвующими в притяжении молекул друг к другу, являются ван-дер-ваальсовы взаимодействия. В связи с этим алканы имеют низкие температуры кипения по сравнению со многими соединениями с близкой молекулярной массой.
Температура кипения у всех разветвленных алканов ниже, чем у нормальных алканов, и притом тем ниже, чем более разветвлена углеродная цепь молекулы (табл. 19).
|
|
|

Рисунок 21 – Зависимость температур плавления, кипения и плотности, 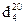 от числа атомов углерода (n) для алканов с неразветвленной цепью
от числа атомов углерода (n) для алканов с неразветвленной цепью
Температура плавления нормальных углеводородов в гомологическом ряду увеличивается медленно. Главным фактором, влияющим на температуру плавления вещества, является плотность упаковки молекулы в кристаллической решетке. Чем симметричнее молекула, тем плотнее ее упаковка в кристалле и тем выше температура плавления. Эти закономерности объясняются следующими причинами:
· превращению жидкости в газ препятствуют ван-дер-ваальсовы силы взаимодействия между атомами отдельных молекул;
· форма разветвленной молекулы стремится к сферической, при этом площадь поверхности соприкосновения уменьшается, что приводит к уменьшению взаимодействия и, следовательно, для преодоления слабых сил взаимодействия требуется меньшая энергия;
· каждая дополнительная группа СН2 вносит довольно постоянный вклад в температуру кипения и плотность и несколько меньший вклад в температуру плавления (рис. 21).
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Алканы намного легче воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан (четыреххлористый углерод), диэтиловый эфир и др.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 966; Нарушение авторских прав?; Мы поможем в написании вашей работы!