
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярно-кинетическая теория газов
|
|
|
|
Кинетическая теория газов основана на следующих общих положениях классической статистической физики:
1. в системе частиц выполняются законы сохранения импульса, момента импульса, энергии, электрического заряда (для систем заряженных частиц) и числа частиц (для закрытых систем, не претерпевающих химических и других превращений);
2. все частицы системы считаются «меченными», т.е. предполагается возможность отличать друг от друга тождественные частицы (например, молекулы одного и того же вещества);
3. все физические процессы в системе протекают в пространстве и времени непрерывно (например, энергия молекулы может изменяться под влиянием внешних воздействий на любую величину, т.е. непрерывно);
4. каждая частица системы может иметь совершенно произвольные значения координат (в пределах объема системы) и компонент скорости совершенно независимо от того, каковы значения этих характеристик у других частиц системы.
Важнейшей задачей кинетической теории газов является вычисление давления (макроскопическое проявление теплового движения молекул) идеального газа на основе молекулярно- кинетических представлений.
Сравнивая уравнение состояния идеального газа и основное уравнение кинетической теории газов, записанные для одного моля (3.2.6’) (для этого число молекул N возьмём равным числу Авогадро NА), найдём среднюю кинетическую энергию одной молекулы: 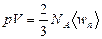 , (3.3.1.)
, (3.3.1.)
или давление, производимое газом, численно равно 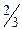 средней кинетической энергии поступательного движения молекул в единице объема (или
средней кинетической энергии поступательного движения молекул в единице объема (или 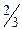 объемной плотности энергии поступательного движения молекул):
объемной плотности энергии поступательного движения молекул): - (3.3.2.)
- (3.3.2.)
основное уравнение кинетической теории газов, где  число молекул в единице объема,
число молекул в единице объема,  средняя кинетическая энергия поступательного движения одной молекулы.
средняя кинетическая энергия поступательного движения одной молекулы.
|
|
|
Т.о. давление химически однородного идеального газа зависит от массы и концентрации молекул, а также от скоростей их теплового движения.
Т.к. 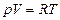 , то
, то  (3.3.3.)
(3.3.3.)
Средняя кинетическая энергия поступательного движения молекулы не зависит от её природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул (в области температур, далеких от  ).
).
Так как 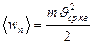 , то средняя квадратичная скорость равна
, то средняя квадратичная скорость равна
 . (3.3.4.)
. (3.3.4.)
Средняя квадратичная скорость является одной из характеристик движения всей совокупности молекул. Она не имеет смысла для одной молекулы или небольшого их числа.
Подставляя значение средней кинетической энергии поступательного движения молекул в основное уравнение молекулярно-кинетической теории газов, получим другую форму уравнения состояния идеального газа: 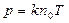 (3.2.6’.)
(3.2.6’.)
Основное уравнение кинетической теории газов Клаузиуса:  , (3.3.5.)
, (3.3.5.)
где 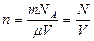 . Формулу можно применять для смеси газов.
. Формулу можно применять для смеси газов.
Средняя кинетическая энергия, приходящаяся на одну степень свободы, 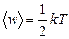 . (3.3.6.)
. (3.3.6.)
Средняя кинетическая энергия (поступательного и вращательного движений) одной молекулы 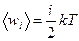 , (3.3.7.)
, (3.3.7.)
где 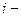 число степеней свободы.
число степеней свободы.
Число 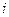 степеней свободы есть число независимых координат, определяющих положение молекулы в пространстве. В зависимости от сложности строения молекулы
степеней свободы есть число независимых координат, определяющих положение молекулы в пространстве. В зависимости от сложности строения молекулы 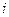 принимает следующие значения (если не учитывать колебаний частей молекул):
принимает следующие значения (если не учитывать колебаний частей молекул):
 для одноатомных газов (молекулу одноатомного газа рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения; при этом энергию вращательного движения не учитывают);
для одноатомных газов (молекулу одноатомного газа рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения; при этом энергию вращательного движения не учитывают);
 для двухатомных газов (молекулу двухатомного газа рассматривают как совокупность двух материальных точек, жестко связанных недеформируемой связью. Имеет три степени свободы поступательного движения и две степени вращательного движения. Вращение вокруг третьей оси – проходящей через оба атома - лишено смысла);
для двухатомных газов (молекулу двухатомного газа рассматривают как совокупность двух материальных точек, жестко связанных недеформируемой связью. Имеет три степени свободы поступательного движения и две степени вращательного движения. Вращение вокруг третьей оси – проходящей через оба атома - лишено смысла);
|
|
|
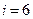 для трех- и многоатомных газов (молекулу трехатомного газа рассматривают как совокупность трех материальных точек, жестко связанных недеформируемой связью. Имеет три степени свободы поступательного движения и три степени вращательного движения).
для трех- и многоатомных газов (молекулу трехатомного газа рассматривают как совокупность трех материальных точек, жестко связанных недеформируемой связью. Имеет три степени свободы поступательного движения и три степени вращательного движения).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 565; Нарушение авторских прав?; Мы поможем в написании вашей работы!