
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эффект сопряжения (резонансный или мезомерный эффект)
Из данных по константам диссоциации замещенных бензойных кислот видно, что влияние заместителей не соответствует представлениям об индуктивном эффекте. Аналогичный вывод может быть получен при рассмотрении дипольных моментов дизамещенных бензолов.
Таблица 12
Значения констант диссоциации замещенных бензойных кислот
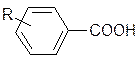
| R | Ка·105 | R | Ка·105 |
| Н | 6,5 | п-NO2 | 36,0 более удалена! |
 п-Cl п-Cl
| 10,4 ожидаемое | м-NO2 | 35,1 |
| м-Cl | 15,4 влияние | п-CH3O | 3,38 (<H!) |
| п-F | 7,22 (!) | м-CH3O | 8,17 |
Эффект сопряжения проявляется в тех случаях, если заместитель имеет π-связи, р-электроны или вакантную низколежащую орбиталь (это может быть B, Si, C ) и находится при атоме углерода в состоянии sp2- или sp-гибридизации (C
) и находится при атоме углерода в состоянии sp2- или sp-гибридизации (C C, С
C, С С, С
С, С Саром.). Происходит перекрывание р- или π-орбиталей заместителя с орбиталями углеродных связей цепи или ароматического кольца. В результате заместитель оказывается связанным с остатком молекулы кроме обычной σ-связи небольшим π-электронным облаком. В этом случае говорят, что р-электроны или π-связи заместителя сопряжены с π-связями остатка молекулы. Таким образом, при сопряжении связи оказываются нецелочисленными, происходит так называемая «делокализация связей».
Саром.). Происходит перекрывание р- или π-орбиталей заместителя с орбиталями углеродных связей цепи или ароматического кольца. В результате заместитель оказывается связанным с остатком молекулы кроме обычной σ-связи небольшим π-электронным облаком. В этом случае говорят, что р-электроны или π-связи заместителя сопряжены с π-связями остатка молекулы. Таким образом, при сопряжении связи оказываются нецелочисленными, происходит так называемая «делокализация связей».
Делокализацией связей (неподеленных пар, зарядов, спинов) называется распределение одной валентной электронной пары (неподеленной пары, заряда, некомпенсированного спина) по нескольким связям (между несколькими атомами).
Делокализация приводит к дробным порядкам связей, дробным зарядам или спинам на атомах, но при этом сумма порядков связей, зарядов и дробных спинов одного атома должна быть равна его классической валентности. В рамках подхода МО-ЛКАО легко показать, что такая делокализация связей, неподеленных электронных пар, зарядов и спинов является энергетически выгодной. В этом заключается причина несоответствия реального распределения электронного облака молекулы схемам, вытекающим из концепции о целочисленности связей или из метода валентных связей.
Для химиков более удобны и привычны атомные и молекулярные модели, полученные из метода валентных связей. Поэтому можно сохранить как классические структурные формулы, так и соответствующие квантовохимические модели, используя для изображения одной молекулы несколько структурных формул, либо одну формулу со стрелками, указывающими так называемые «электронные смещения», или нецелочисленными связями и дробными зарядами. При этом истинная структура молекулы представляется сочетанием формул электронных изомеров, называемых резонансными (или предельными, или каноническими) структурами. Следует отметить, что электронные изомеры не существуют как отдельные частицы, нет никакого равновесия между ними, истинная молекула представляет собой нечто усредненное, гибридное, промежуточное между ними.
Правила обращения с классическими атомными моделями (на языке метода валентных связей) при конструировании из них моделей молекул
Введены следующие три правила резонанса (мезомерии, сопряжения):
1) Каждая из р-орбиталей перекрывается с р-орбиталями всех соседних атомов, если выполнено условие копланарности (параллельности осей симметрии р-орбиталей). Все копланарные атомы расположены в одной плоскости, которая совпадает с общей узловой поверхностью соответствующих р-орбиталей.
2) р-электрон способен к частичной компенсации своего спина с несколькими другими р-электронами, находящимися на соседних копланарных р-орбиталях, причем часть спина может при этом оставаться некомпенсированной. Частичной компенсации спинов соответствуют дробные π-связи.
3) Одна и та же пара р-электронов может одновременно образовывать несколько π-связей и наряду с этим обладать частично свойствами неподеленной пары на одной из атомных р-орбиталей.
На этих трех постулатах основано представление о резонансе, мезомерии или сопряжении π-электронных систем. Эти три термина в определенной степени перекликаются.
Термин «резонанс» пришел из квантовой механики.
«Мезомерия» – чисто химическое понятие. Мезомерия дословно переводится как «между частями». Это понятие подразумевает промежуточность реальной структуры молекулы (в распределении зарядов и связей) по сравнению с гипотетическими структурами, изображенными посредством нескольких классических структурных формул; другими словами, точное представление структуры является промежуточным между двумя или более формулами Льюиса.
Термин «сопряжение» первоначально выражал чередующееся расположение ординарных и двойных связей. Постепенно им стали обозначать все случаи резонанса или мезомерии, связанные с участием во взаимодействии p-орбиталей. Так как наиболее важные приложения резонансных (мезомерных) представлений относятся к таким системам, то, как правило, в органической химии все три термина употребляют как синонимы.
Резонансное взаимодействие имеет место во всех случаях, когда электронное строение молекулы не может быть отражено только одной предельной структурой. Различные предельные структуры называются резонирующими каноническими структурами, а реальное основное состояние молекулы, изображаемое их совокупностью, является «резонансным гибридом» этих предельных структур. Выигрыш энергии (энергетическая стабилизация молекулы) по сравнению с наиболее стабильной по аддитивной оценке предельной структурой называется энергией резонанса. В связи с этим и говорят о резонансной стабилизации молекул.
Рассмотрим, как изображаются аллильные частицы (катион, анион, радикал) с помощью резонансных (канонических) структур, «классических» структур с изогнутыми стрелками и структур с нецелочисленными связями:
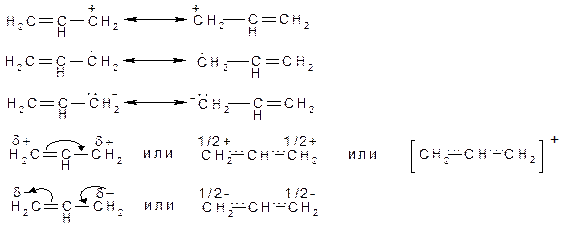
Крайнее правое обозначение аллильного катиона наиболее близко к его реальной структуре.
|
|
Дата добавления: 2014-01-07; Просмотров: 740; Нарушение авторских прав?; Мы поможем в написании вашей работы!