
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа
|
|
|
|
Давление смеси газов равно сумме парциальных давлений каждого газа.
Подставляя формулу (1.3.1), связывающую среднюю кинетическую энергию поступательного движения молекулы с абсолютной температурой: 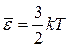 , в основное уравнение МКТ (1.4.12), получим уравнение, уже не содержащее микроскопических параметров состояния и являющееся мостиком от основного уравнения МКТ к уравнению состояния идеального газа.
, в основное уравнение МКТ (1.4.12), получим уравнение, уже не содержащее микроскопических параметров состояния и являющееся мостиком от основного уравнения МКТ к уравнению состояния идеального газа.
 . (1.6.1)
. (1.6.1)
Т.к. концентрация молекул 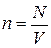 , то получим уравнение, связывающее следующие четыре параметра состояния: (давление P, объём V, абсолютная температура T и число молекул N).
, то получим уравнение, связывающее следующие четыре параметра состояния: (давление P, объём V, абсолютная температура T и число молекул N).
 . (1.6.2)
. (1.6.2)
Пользуясь соотношением  , получим связь параметров: (давление P, объём V, абсолютная температура T, масса газа m).
, получим связь параметров: (давление P, объём V, абсолютная температура T, масса газа m).
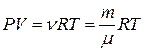 (уравнение Менделеева-Клапейрона), (1.6.3)
(уравнение Менделеева-Клапейрона), (1.6.3)
где 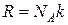 – универсальная газовая постоянная.
– универсальная газовая постоянная.
Уравнения (1.6.2) и (1.6.3) называются уравнениями состояния идеального газа.
Подставляя значения постоянных Авогадро и Больцмана, получим значение универсальной газовой постоянной:
 .
.
Другой способ вычисление универсальной газовой постоянной основан на известном из химии законе Авогадро: моль любого газа при нормальных условиях занимает один и тот же объем V0m = 22,4 л = 22,4×10-3 м3.
Газ находится при нормальных условиях, если его абсолютная температура равна T0 = 273,15 К (0°C), а давление P0 = 1 атм = 1,013×105 Па.
Тогда 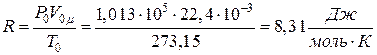 .
.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 254; Нарушение авторских прав?; Мы поможем в написании вашей работы!