
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение концентраций газов и кислот при дальнем переносе
|
|
|
|
Без учета турбулентной диффузии, т.е. рассеяния веществ в пространство, превращения веществ может быть представлены в виде блоков на рис. 1, где преобразования серо и азотсодержащих веществ происходит со скоростями удаления данными в Таблице 2. На этой блок-схеме для окислов азотов NOx допущено также равновесие между оксидами при [NO2]/[NO]=2 и их дополнительный их сток в пироксиацилнитраты в результате фотохимического смога (лекция 8).
Такая блок-схема, позволяет записать изменение каждой из фаз вещества-загрязнителя в виде (уже известного вам) кинетического уравнения первого рода:
 (1)
(1)
где [Сi] молярная концентрация вещества в i -том блоке, а коэффициенты скорости преобразования или удаления lj (gj для окислов азота) определенного потока j из этого блока, представлены в Таблице 2 в соответствии с оценками п.9.1. Изменение [молярной концентрации сернистого газа] записывается, как (2):
 (2)
(2)
Но изменение молярной концентрации серной кислоты будет зависеть от прихода окисленного SO2 и стока со скоростями λ4-6:
 (3)
(3)
Решение уравнений 2 и 3, при условии, что начальная концентрация сернистого газа равна [SO2]0 дает следующие формулы для изменения количества газа [SO2]t и кислоты [H2SO4]t во времени:
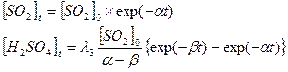 (4)
(4)
Придя к формулам (4), мы находим ответ, на вопрос: «зачем были необходимы оценки скоростей реакций в которые вступают газы и аэрозоли?». Дело в том, что в (4) концентрация сернистого газа [SO2]t убывает экспоненциально со временем, а концентрация аэрозоли серной кислоты [H2SO4]t сначала растет до макcимального значения в момент Тmах и лишь затем убывает (вспомните концентрацию примеси от точечного источника). Это максимальное значение достигается в момент времени когда
|
|
|
 (5)
(5)
Подставляя значения α и β из таблицы 2, получаем время через которое содержание кислоты наибольшее Tmax =ln(1,4)/0,015 час = 22,7 часов, т.е. около суток. Позволим себе интерпретировать это интервал времени, как промежуток между выбросом диоксида серы и максимумом концентрации серной кислоты в воздушной массе, прошедшей достаточно протяженный «сернистый» регион. Слово «протяженный» означает, что можно пренебречь рассеянием примеси (смешением с окружающим воздухом) по крайней мере в центре объёма воздуха уносимого от региона загрязнения. При характерной скорости переноса воздушной массы в 20-30 км/ч, очевидно, что наибольшие значения концентрации серной кислоты будут наблюдаться на удалении 450-700 км от источника.
Быстрое газофазное окисление g3=0,12 окислов азота ведет к тому, что максимум концентрации азотной кислоты наблюдается уже через ln(165/42)/(0,165-0,042) =11 часов переноса т.е. уже в 200-300 км от источника при характерных скоростях атмосферного слоя.
Представление трансформации веществ через скорости их реакций дает нам в руки эффективный инструмент для описания масштабов зон возможного загрязнения с учетом физического и химического состава примеси. Действительно, для описания масштабов загрязнения можно использовать не только абсолютные значения концентраций (много или мало), но и средний период выведения примеси тем или иным атмосферным процессом.
Таблица 2. Характерные скорости процессов превращения и удаления кислотообразующих примесей из атмосферы.
| Процесс, скорость в ч-1 | SO2 | H2SO4 | NOx | HNO3 (1/2газ+1/2аэрозоль) |
| Окисление | l3=0,027 | g3=0,12 | ||
| Взаимодействие с органикой | g6=0,025 | |||
| Поглощение подстилающей поверхностью | l2=0,015 | l4=0,005 | g2=0,01 | g4=0,01 |
| Вымывание осадками | l1=0,01 | l5=0,012 | g1=0,01 | g5=0,012 |
| Нейтрализация в виде аэрозоли | l6=0,02 | g7=0,02 | ||
| Суммарная скорость выведение из атмосферы | a=0,052 | b=0,037 | 0,165 | 0,042 |
Анализируя скорости реакций (таблица 2). можно сделать простое заключение о «индикаторе» поступления загрязнения от источника на поверхность земли. В начальные моменты времени, когда в смеси кислота-газ доминирует газ, в удалении примеси главную роль играет поглощение газа поверхностью земли, т.е. сухое удаление. Когда окисление газа зашло достаточно далеко, главную роль начинают играть процессы вымывания примесей с осадками и процессы нейтрализации кислот. Несмотря на то, что сумма коэффициентов вымывания l1+l5 и поглощения l2+l4 кислот и газа поверхностью примерно равны, быстрое окисление газа днём приводит к тому, что осадки – это доминантный процесс поступлении кислоты на поверхность почвы.
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 284; Нарушение авторских прав?; Мы поможем в написании вашей работы!