
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Ле-Шателье
Смещение химического равновесия.
Изменение температуры реакции, концентраций реагентов, давления в системе (только для газов) приводят к нарушению равенства 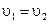 , а значит, к нарушению состояния равновесия в системе. Через некоторое время равенство скоростей прямой и обратной реакций снова восстанавливается. Однако, равновесные концентрации в новых условиях реакции принимают новые значения.
, а значит, к нарушению состояния равновесия в системе. Через некоторое время равенство скоростей прямой и обратной реакций снова восстанавливается. Однако, равновесные концентрации в новых условиях реакции принимают новые значения.
Переход системы из одного равновесного состояния в другое называется смещением равновесия.
Смещение равновесия определяется закономерностью, известной под названием принципа Ле-Шателье, т.е. принципа подвижного равновесия: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то равновесие смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
Влияние концентраций реагирующих веществ на состояние равновесия
Пример:

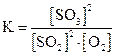 . Увеличение концентрации
. Увеличение концентрации 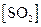 , или
, или 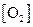 , в соответствии с принципом Ле-Шателье, вызывает сдвиг равновесия вправо, а увеличение концентрации
, в соответствии с принципом Ле-Шателье, вызывает сдвиг равновесия вправо, а увеличение концентрации  - влево.
- влево.
Следовательно, увеличение концентраций исходных веществ вызывает смещение химического равновесия в сторону увеличения продуктов реакции, а увеличение концентраций продуктов реакции – в сторону увеличения реагентов.
Влияние давления на состояние химического равновесия
Давление оказывает существенное влияние только на газообразные системы, т.к., только в них возможно большое изменение объема равновесной системы.
При увеличении давления повышаются концентрации реагирующих веществ, а значит, и скорость химической реакции.
При взаимодействии газообразных веществ можно представить три случая.
1. Суммарное число молей исходных веществ равняется суммарному числу молей продуктов реакции.
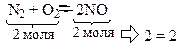
Если увеличить давление в системе в два раза, то, соответственно, объем уменьшится в два раза, а значит, увеличатся в два раза концентрации газов. Скорости прямой и обратной реакций возрастают, но в равное число раз. Поэтому в этом случае смещения состояния химического равновесия в системе не произойдет.
Следовательно, если объемы исходных и конечных продуктов реакции равны, то изменение давления не нарушает состояние химического равновесия в системе.
2. Суммарное число молей исходных веществ больше, чем суммарное число молей продуктов реакции.
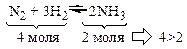
В этом случае суммарные объемы газов, вступающих в реакцию, больше суммарных объемов газообразных продуктов реакции. Таким образом, эта реакция протекает с уменьшением объема.
При повышении давления в системе равновесие смещается в сторону меньшего числа молей, т.е. в сторону образования аммиака.
3. Суммарное число молей исходных веществ меньше, чем суммарное число молей продуктов реакции.
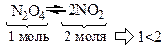
Если при равновесии повысить давление в системе, то эта система окажет противодействие, стремясь к первоначальному состоянию. Химическое равновесие сместится в сторону обратной реакции, сопровождающейся понижением давления. Если при равновесии понизить давление в системе, то равновесие сместится в сторону прямой реакции, приводящей к повышению давления, т.е. возрастет концентрация диоксида азота.
Таким образом, повышение давления сдвигает равновесие в сторону меньших объемов, а понижение давления – в сторону больших объемов.
Влияние температуры на состояние равновесия
В соответствии с принципом Ле-Шателье, повышение температуры в системе вызывает смещение химического равновесия в сторону эндотермического процесса, а уменьшение температуры – в сторону экзотермического процесса.
Значит, необходимо знать тепловой эффект реакции. Направление смещения равновесия определяется знаком теплового эффекта реакции, а степень смещения равновесия – величиной ΔН, т.е. чем больше ΔН, тем сильнее влияние температуры.
Определим, как влияет температура на направление смещения равновесия в системе:
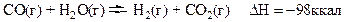
Т.к. прямая реакция – экзотермическая, то при нагревании системы химическое равновесие будет смещаться влево, а при охлаждении – вправо.
При величине ΔН, близкой к нулевому значению, температура практически не влияет на состояние химического равновесия.
Для выбора оптимальных условий протекания химической реакции необходимо учитывать не только влияние на равновесие всех факторов: температуры, давления, концентрации, но и еще их влияние на скорость процессов.
Пример: получение аммиака

Образование аммиака сопровождается уменьшением числа молей, поэтому сместить равновесие вправо можно путем увеличения давления. Поскольку реакция экзотермическая, ее следует проводить при низких температурах. Но ниже 400?С скорость химической реакции очень мала, и состояние равновесия наступает через большой промежуток времени. Следовательно, процесс становится нерентабельным. Поэтому синтез аммиака проводят при повышенном давлении (примерно 30–50МПа) и при температуре 400-500°С. В качестве катализатора используют губчатое железо. Таким образом, экономически выгоднее проводить технологический процесс с меньшим выходом продукта, но за более короткий срок.
Катализатор не влияет на состояние химического равновесия в системе.
|
|
Дата добавления: 2014-01-07; Просмотров: 1884; Нарушение авторских прав?; Мы поможем в написании вашей работы!